
10.
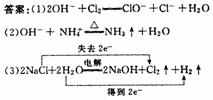
(4)泄露处有白烟产生 8NH3+3Cl2=N2+6NH4Cl
[命题立意]考查了元素及化合物知识以及学生推理问题的能力。
[解析]该题的推断突破口是F的性质,通过其水溶性,可做制冷剂的性质可推断F为NH3。另外一个推断突破口是反应②,一种溶液电解产生三种物质,其中两种为气体,所以可以联系到氯化钠溶液的电解,由此推知B为NaCl、A为N2、C为H2、D为Cl2、E为NaOH溶液,所以G为NH4Cl。
(1)这是氯气溶解在NaOH溶液中的反应,产物NaClO为消毒剂、漂白剂。
(2)铵根离子的检验是中学化学中的重要的基本操作,方法是在待检测溶液(铵盐溶液)中加入碱液,然后微热,再检验氨气的产生。
(3)饱和氯化钠电解的反应中Cl-被氧化(失电子),产物为氯气,水中的氢得电子,被还原,产物为氢气。
(4)氯气与氨气发生氧化还原反应先生成HCl,HCl与NH3迅速结合生成NH4Cl这种白烟。
9. 
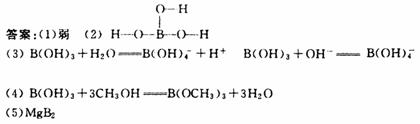
[命题立意]考查学生对已给信息的理解和综合应用的能力
[解析](1)从题目信息中硼酸的用途可知其为弱酸。
(2)由于B原子外层3个电子,而硼酸中H与O成键,即H与O形成羟基,羟基氧原子连接在B原子上,所以每个羟基可以提供1个电子与B原子共用,因此硼酸结构简式为:B(OH)3
(3)硼酸中B原子属于缺电子原子,所以水溶液中可以结合水电离出的氢氧根,破坏水的电离平衡而使溶液显酸性。
(4)在酯化反应中硼酸的三个羟基类似于羧酸中的羟基,-OH与甲醇中的氢原子结合生成水。
(5)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为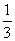 ;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为
;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为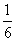 。由此可知
。由此可知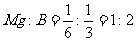
8.[答案]C
[命题立意]旨在考查不同类型混合物的分离方法
[解析]A是用容量瓶配制一定物质的量浓度的溶液;B为过滤操作,分离固液混合物;C为蒸馏操作,分离液体混合物;D为渗析,分离溶液与胶体。
7.[答案]D
[命题立意]旨在考查外界条件对化学平衡的影响
[解析]如果是增大了X或Y的浓度,则在t2时刻X或Y浓度应突然增大,故A不正确,同理可排除C。加催化剂平衡不移动,各组分浓度不变,B也不正确。升高温度平衡逆向移动,使X、Y浓度增大,Z浓度减少,故D正确。
6. [答案]C
[命题立意]考查对阿伏加德罗常数的理解

 [解析]根据化学方程式计算生成的NO2为0.5mol,剩余的O2为0.25mol,即气体的总物质的量为0.75mol,但存在2NO2 N2O4,故体系中气体的总分子数小于0.75mol,A错;如果是环丙烷,则一个分子含有的C-C单键数为3个,故B错;标准状况下,水为液体,D错。
[解析]根据化学方程式计算生成的NO2为0.5mol,剩余的O2为0.25mol,即气体的总物质的量为0.75mol,但存在2NO2 N2O4,故体系中气体的总分子数小于0.75mol,A错;如果是环丙烷,则一个分子含有的C-C单键数为3个,故B错;标准状况下,水为液体,D错。
5.[答案]C
[命题立意]考查苯及氨基酸的结构以及同分异构体的概念
[解析]三聚氰胺中含有的不是苯环,但含有3个氨基,A错;三聚氰胺中尽管含有氨基,但无羧基,故不是氨基酸,B错;三聚氰胺被不法分子用于提高奶粉的蛋白质含量,C正确;三聚氰胺分子式为C3H6N6,而三聚氰酸为C3H3O3N3,二者不是同分异构体,D错。
4.[答案]C
[命题立意]考查NO2的实验室制法及性质
[解析]根据题目提示信息可知A、B分别为NO2、NO。这两种分子是含有氮氧极性键的极性分子,A、B正确;NO2、NO都不是酸酐,C错;NO2比NO多一个O原子,故D正确。
3. [答案]B
[命题立意]考查元素周期表及元素周期律
[解析]同周期中,第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强;第ⅥA族元素中,氢化物稳定性最好的是H2O,常温下是液体,沸点最高;NH4Cl为离子化合物,故C错误;同周期中,金属元素的最高价离子与非金属的最低价离子电子层数不同,故D错误。
2.[答案]B
[命题立意]旨在考查离子共存及氧化还原反应
[解析]选项A中的离子在强酸性条件下不能发生氧化还原反应;B中的ClO-、Cl-在强酸溶液中能发生氧化还原反应,生成氯气;C中的Fe2+在碱性条件下不能共存;D中的NH4+不能存在于碱性条件下,而且该组离子在强酸性条件下也不能发生氧化还原反应。
1. [答案] D
[命题立意]:本题旨在提倡中学生经常用化学视角去观察和思考日常生活中的化学问题。
[解析]盐类融雪的原理主要是因为盐溶于水后,使溶液的凝固点降低,故选项A、B均错误;盐溶解在融化的雪水中,使这种雪水成为一定浓度的盐水,这种盐水能够损害大多数植物,故C错误;钢筋混凝土中的钢筋与高浓度的盐水形成吸氧腐蚀,故正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com