
23.(10分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,;种是固体。请回答下列问题:
(1)B元素单质的电子式 ,F元素氧化物的晶体类型为 。
(2)由A、C两元素可组成X、Y两种化合物,X在MnO2作用下可以分解成Y,写出X转化为Y的化学方程式 。
(3)若E是非金属元素,但能表现出一些金属元素的性质。写出E与D的氧化物的水溶液反应的离子方程式 。
(4)一定条件下,A的单质与B的单质充分反应生成6.8gW气体时,可放出18.48kJ热量,写出该反应的热化学方程式 。
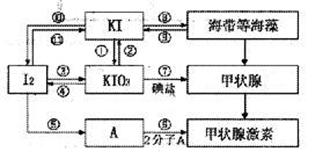 24.(8分)甲状腺激素对于人和高等动物具有极其重要的生理作用,下图是关于碘及其化合物与甲状腺素的转化网络图示。
24.(8分)甲状腺激素对于人和高等动物具有极其重要的生理作用,下图是关于碘及其化合物与甲状腺素的转化网络图示。
(1)请写出在强酸性条件下,由KI和KIO3反应制得I2的离子方程式: 。
(2)上述图示中,碘元素发生氧化反应的过程有 (填序号)。
(3)制备KIO3的方法较多:利用③的原理是I2在一定条件下还原KclO3,写出该反应的化学方程式: 。
|
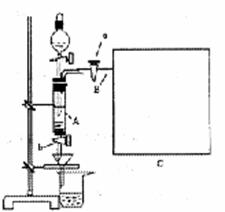 试写出阴极反应方程式:
。
试写出阴极反应方程式:
。
22. (10分)(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol
N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。
(10分)(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol
N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。
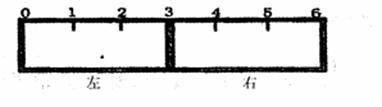 (2)有一带有刻度的容器被一种特殊的隔膜分成左右两部分,如下图所示:
(2)有一带有刻度的容器被一种特殊的隔膜分成左右两部分,如下图所示:
若该隔膜为阳离子交换膜(只允许阳离子自由通过),且将该膜固定在3处,左边充满滴有少量KSCN溶液的FeCl2溶液,右边充满酸性KMnO4溶液,一段时间后可观察到的现象:左 ,右 。(从下列选项中选择)
A.无观显现象 B.溶液变为红色
C.溶液红色变浅 D.有红褐色沉淀生成
试写出右边产生该现象的离子方程式 。
(3)已知下列数据:
Fe(s)+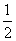 O2(g)
O2(g) FeO(s) △H=-272。0 kJ·mol-1
2X(s)+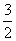 O2(g)
O2(g) X2O3(s) △H=-1675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是 。
21.(10分)描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
表1
|
难(微)溶物 |
溶度积常数(Ksp) |
|
BaSO4 |
1×10-10 |
|
BaCO3 |
2.6×10-9 |
|
CaSO4 |
7×10-5 |
|
CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),理由是 ,
溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应
≥ mol·L-1
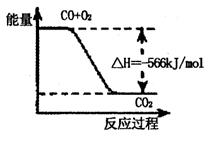
20.已知:2CO(g)+O2(g)=2CO2(g)
△H=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+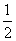 O2
(g)
O2
(g)
△H=-226ld·mol-1
根据以上热化学方程式判断,下列说法正确的是 ( )
A.CO的燃烧热为283kJ
B.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452kJ·mol-1
C.下图可表示由CO生成CO2的反应过程和能量关系
D.CO(g)与Na2O2反应放出509kJ热量时,电子转移数为6.02×1023
19.某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是 ( )
A.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
B.若向该溶液中加入过量的稀硫酸,产生的气体在空气牟能变成红棕色
C.若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
18.某酸性溶液中只含有NH4+、Cl-、H+、OH-4种离子,下列说法不正确的是 ( )
A.可由pH=3的HCl与pH=11的NH3·H2O溶液等体积混合而成
B.该溶液中离子间一定满足:c(NH4+)+c(H+)= c(OH-)+c(Cl-)
C.加入适量NH3·H2O,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(OH-)>c(H+)
D.该溶液可能由等物质的量浓度、等体积的HCl溶液和NH3·H2O溶液混合而成
17.有四种混合溶液,分别由等体积0.1mol·L-的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列关于该四种混合溶液的各项排序正确的是 ( )
A.pH;②>③>④>① B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH:①>④>③>②
16.控制适合的条件,KI溶液过量,将反应
2Fe3++2I-=2Fe2++I2设计成如下图所示的原电池。
下列判断正确的是 ( )
A.反应开始时,甲中石墨电极上Fe3+发生氧化反应
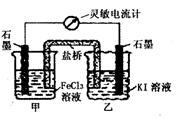 B.反应开始时,乙中石墨电极的反应式:
B.反应开始时,乙中石墨电极的反应式:
I2+2e-=2I-
C.电流计读数为零时,在甲中加入KSCN溶液,
出现血红色
D.电流计读数为零时,反应处在停止状态
14.化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶人锌块,可减缓船体的腐蚀速率
C.工业制铝的原料是A1C13,可以降低能耗
D.MgO的熔点很高,可用于制作耐高温材料
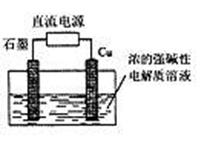
|
A.石墨电极上产生氢气
B.铜电极反应为:2Cu-2e-+2OH- Cu2O+H2O
C.铜电极接直流电源的正极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
11.下列实验设计和结论相符合的是 ( )
A.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体一定显碱性
C.在蒸馏水中加入少量FeCl3固体,可得纯净的FeCl3溶液
D.某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
|
 12.2SO2(g)+O2 (g)
2SO3 (g)是制备硫酸的重要反应。下列叙述正确的是( )
12.2SO2(g)+O2 (g)
2SO3 (g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5增加该反应的正反应速率而不改变逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.进入接触室的SO2和空气必须进行净化,且该反应不需要在高压下进行
D.该反应是放热反应,降低温度将缩短反应达到平衡的时间
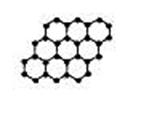 13.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
13.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含6.02×l022个碳原子
C.石墨烯是一种化合物
D.在整个单层片结构中属于每个六边形的碳原子数实际为2个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com