
1.已知全集U和集合A,B如图所示,则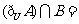
A.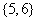 B.
B.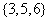
C.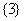 D.
D.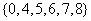
61、如图所示,在xoy平面上第Ⅰ象限内有平行于y轴的有界匀强电场,方向如图,y轴上一点P的坐标为(0,y)有一电子以垂直于x轴的初速 度v0从P点垂直射入电场中,当匀强电场的场强为E1时,电子从A点射出,A点坐标为(xA,0)当场强为E2时,电子从B点射出,B点坐标为(xB,0),已知电子的电量为e,质量为m,不计电子的重力。
度v0从P点垂直射入电场中,当匀强电场的场强为E1时,电子从A点射出,A点坐标为(xA,0)当场强为E2时,电子从B点射出,B点坐标为(xB,0),已知电子的电量为e,质量为m,不计电子的重力。
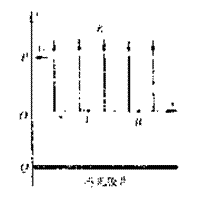 (1)求匀强电场的场强,E1、E2之比;
(1)求匀强电场的场强,E1、E2之比;
(2)若在IV象限过Q点放一张垂直于xoy平面的感光胶片,Q点的坐标为(0,-y)求感光胶片上曝光点的横坐标xA、xB之比。
60、如图所示,电场极板AB间有电场强度 的匀强电场,一带电量
的匀强电场,一带电量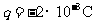 的小球开始时静止在电场中的
的小球开始时静止在电场中的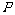 点,靠近电场极板B处有一挡板S,小球与挡板S的距离
点,靠近电场极板B处有一挡板S,小球与挡板S的距离 ,与
,与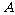 板距离
板距离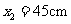 ,小球的重力不计.在电场力作用下小球向左运动,与挡板S相碰后电量减少到碰前的K倍,已知
,小球的重力不计.在电场力作用下小球向左运动,与挡板S相碰后电量减少到碰前的K倍,已知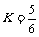 ,碰撞过程中小球的机械能没有损失.
,碰撞过程中小球的机械能没有损失.
(1)求小球第一次到达挡板S时的动能;
(2)求小球第一次与挡板S相碰后向右运动的距离;
(2)小球与挡板S经过多少次碰撞后,才能运动到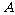 板?
板?
解:(1)小球第一次到达挡板时,由动能定理得
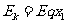 =0.02J
(3分)
=0.02J
(3分)
(2)设小球与挡板相碰后向右运动s,则
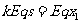 (2分)
(2分)
 (1分)
(1分)
(3)分析题意可知,每次碰后向右运动的距离是前一次的1/k,
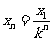
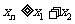 (4分)
(4分)
n=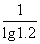 =13
(2分)
=13
(2分)
59、带等量异种电荷的两平行金属板相距L,板长H,竖直放置,x轴从极板中点O通过,如图所示。板间匀强电场的场强为E,且带正电的极板接地。将一质量为m、电量为+q的粒子(重力不计)从坐标为x0处释放。
(1)试从牛顿第二定律出发,证明该带电粒子在极板间运动的过程中,电势能与动能总和保持不变。
(2)为使该粒子从负极板上方边缘的P点射出,须在x0处使该粒子获得竖直向上的初速度v0为多大?
解:(1)在带电粒子运动方向上任取一点,设其坐标为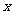 ,取接地极板为零势能点。将粒子从O点移到
,取接地极板为零势能点。将粒子从O点移到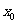 处电场力做正功,
处电场力做正功, ,即粒子在x处的电势能为
,即粒子在x处的电势能为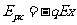 ,在
,在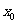 处的电势能为
处的电势能为 。
。
再由牛顿第二定律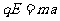 ①,
①,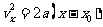 ②,解得
②,解得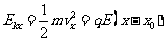 ③,又
③,又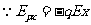 ④,
④, ⑤,
⑤,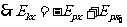 ,得
,得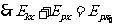 ⑥,即该带电粒子在极板间运动的过程中,电势能与动能总和保持不变,证毕。
⑥,即该带电粒子在极板间运动的过程中,电势能与动能总和保持不变,证毕。
(2)粒子在竖直向上射出后做类平抛运动。故竖直方向做匀速直线运动,到达P点时有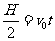 ⑦;水平方向做初速度为零的匀加速运动,有
⑦;水平方向做初速度为零的匀加速运动,有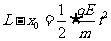 ⑧,联立解得
⑧,联立解得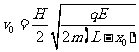
评分标准:(1)(8分)写出①②两式各得1分,再写出③式得2分;写出④⑤两式各得1分,再写出⑥式得2分。(2)(7分)写出⑦⑧两式各得3分,得到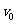 的值再得1分。本题第(1)小题多解,其他方法,结果正确且说理充分可酌情得分。
的值再得1分。本题第(1)小题多解,其他方法,结果正确且说理充分可酌情得分。
58、如图所示,水平放置的平行板电容器,原来两板不带电,上极板接地,它的极板长L = 0.1m,两板间距离
d = 0.4 cm,有一束相同的带电微粒以相同的初速度先后从两板中央平行极板射入,由于重力作用微粒能落到下板上,微粒所带电荷立即转移到下极板且均匀分布在下极板上.设前一微粒落到下极板上时后一微粒才能开始射入两极板间。已知微粒质量为 m = 2×10-6kg,电量q = 1×10-8 C,电容器电容为C =10-6 F,取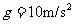 .求:
.求:
 (1)为使第一个微粒的落点范围能在下板中点到紧靠边缘的B点之内,求微粒入射的初速度v0的取值范围;
(1)为使第一个微粒的落点范围能在下板中点到紧靠边缘的B点之内,求微粒入射的初速度v0的取值范围;
(2)若带电微粒以第一问中初速度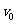 的最小值入射,则最多能有多少个带电微粒落到下极板上?
的最小值入射,则最多能有多少个带电微粒落到下极板上?
解析:(14分)(1)若第1个粒子落到O点,由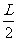 =v01t1 (1分)
=v01t1 (1分)
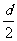 =
=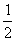 gt12 (1分) 得v01=2.5 m/s (1分)
gt12 (1分) 得v01=2.5 m/s (1分)
若落到B点,由L=v02t1,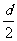 =
=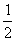 gt22得v02=5 m/s(3分)
gt22得v02=5 m/s(3分)
故2.5 m/s< v0<5 m/s(1分)
v0<5 m/s(1分)
(2)由L=v01t (1分) 得t=4×10-2 s (1分)
由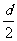 =
=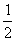 at2 (1分)
得a=2.5 m/s2 (1分)
at2 (1分)
得a=2.5 m/s2 (1分)
由mg-qE=ma,E=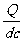 (1分)得Q=6×10-6 C (1分)
所以
(1分)得Q=6×10-6 C (1分)
所以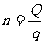 =600个 (1分)
=600个 (1分)
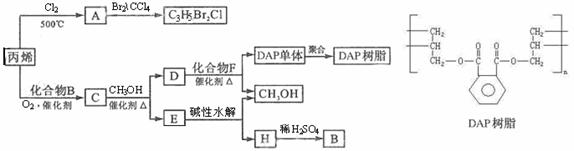
29.丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;
 已知酯与醇可以发生如下酯交换反应:
已知酯与醇可以发生如下酯交换反应:
(I):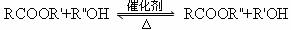 (R,R’ R’’代表羟基)
(R,R’ R’’代表羟基)
(Ⅱ):C与甲醇的反应和D与F的反应均属于酯交换反应。
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是______________________
A 含有的官能团名称是______________________;
②由丙烯生成A的反应类型是______________________
(2)A水解可得到D,该水解反应的化学方程式是______________________。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为
碳60%,氢8%,氧32% ,C的结构简式是______________________。
(4)下列说法正确的是(选填序号字母)___________
a. C能发生聚合反应,还原反应和氧化反应
b. C含有两个甲基的羧酸类同分异构体有4个
c. D催化加氢的产物与B具有相同的相对分子质量
d. E有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是______________________
(6)F的分子式为C10H10O4 ;DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式_________________________。
28.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生双水解反应: 2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,需要用到纯净的氯化铁和亚硫酸钠,同学们经过讨论设计并实施了下列实验,请填写下列空白:
[实验Ⅰ]学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 ______________________。
[实验Ⅱ]取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ,向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 ;将该溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
[实验Ⅲ]换用稀释的FeCl3和Na2SO3溶液重复上述实验,实验Ⅲ产生的现象与实验Ⅱ完全相同。由上述实验得出的结论是 。
[实验Ⅳ]若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是_______________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①___________________________________;②________________________________。
27. A、B、C、D、E、F、G都是元素周期表中前20号元素,原子序数依次增大。
①A、D同主族,C和F同主族;
②B分别与A、C、F形成的化合物分子均呈正四面体结构,且B位于正四面体的体心;
③D、E、F同周期,且D、E、F的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)C和F氢化物中,沸点较低的是 (选填“C” 或“F”);
(2)B分别与A、C、F所形成的分子中沸点由高到低的顺序为: (填分子式用“>”隔开);
(3)C和D的离子中,半径较小的是 (填离子符号)。
(4)元素E与F形成的化合物沸点为182.7℃,易升华,它在熔融状态下不导电,但在水溶液中能够能够导电,属于强电解质,该固体化合物的晶体类型为: 。
(5)D、E的最高价氧化物的水化物发生反应生成盐和水的离子方程式: 。
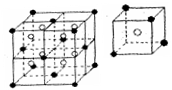 (6)C和G可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。
(6)C和G可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。
该化合物的电子式是 。
26.按要求填空。
①NaCl晶体:在NaCl晶体中,每个Na+周围与之最接近且等距离的Cl-有 个,这几个Cl-在空间的几何构型为 。
②SiO2晶体:在SiO2晶体中,每个Si原子周围结合 个O原子,同时每个O原子跟 个Si原子相结合。4.5g SiO2晶体中Si-O键的个数为 NA。
③CO2晶体:CO2和SiO2的晶体结构不同。在CO2晶体中,每个CO2分子周围有 个与之最近且等距离的CO2分子,距离为 。(设晶胞边长为a,用a表示)
④白磷晶体:白磷(P4)分子的空间结构为 ,31g白磷中P-P键的数目为 NA;
若将1分子白磷中的所有P-P键打开并各插入一个氧原子,则1分子白磷可结合 个氧原子。
 ⑤晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_____个硼原子组成,共含有______B-B键。(背面图形无法画出)
⑤晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_____个硼原子组成,共含有______B-B键。(背面图形无法画出)
⑥胶体的制备:将少量饱和的氯化铁溶液滴入沸水中,可制备氢氧化铁胶体。
离子反应方程式如下: 。
25. 20世纪90年代,科学家发现并证明碳有新的单质形态C60存在。后来又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状分子,碳大大丰富了碳元素单质的家族。下列有关说法错误的是( )
20世纪90年代,科学家发现并证明碳有新的单质形态C60存在。后来又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状分子,碳大大丰富了碳元素单质的家族。下列有关说法错误的是( )
A.熔点比较:C90<金刚石
B.金刚石与C70 管状碳和洋葱状碳都是石墨的同素异形体
C.已知C(石墨,s)= C(金刚石,s);△H>0,则石墨比金刚石稳定
D.C60晶体如图,每个C60分子周围与它距离最近且等距离的C60分子有10个
第Ⅱ卷 非选择题 共4小题,共50分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com