
11.利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
|
|


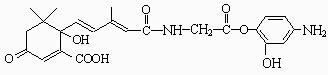
A.X结构中有2个手性碳原子
B.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐。
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH, 1 molY最多能加成4 molH2。
1 molY最多能加成4 molH2。
10.将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe 3+的酸性溶液中,溶液变成红
3+的酸性溶液中,溶液变成红
色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中
通入SO2,红色也褪去。下列推测肯定不正确的是
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2
9.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c (Na+) >c (CH3COO-)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:
c(Na+) = c(SO42-) >c(NH4+) >c(H+) >c(OH-)
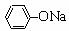 C.NaHCO3溶液中:c(OH-)- c(H+)=c(H2CO3) - c(CO32-)
C.NaHCO3溶液中:c(OH-)- c(H+)=c(H2CO3) - c(CO32-)
D.在浓度均为0.1 mol·L-1Na2CO3、NaHCO3、 、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1。
8.下列实验设计能够成功的是
|
|
实验目的 |
实验步骤及现象 |
|
A |
检验亚硫酸钠 试样是否变质 |
 |
|
B |
检验某卤代烃 是否是氯代烃 |
 |
|
C |
证明酸性条件下 H2O2氧化性比I2强 |
 |
|
D |
证明Ksp(BaSO4)>Ksp(BaCO3) |
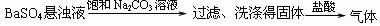 |
7.下列离子方程式与所述事实相符且正确的是
A.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
B.Na2S溶液吸收足量SO2:S2-+2SO2 +2 H2O =2HSO3- + H2S↑
C.向2 mol·L-1Fe(NO3)2溶液中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
 D.用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:
D.用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:
Cu2+ + 2Br- Cu +Br2
6.下列有关实验操作或对实验的描述正确的是
A.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体
 B.用苯萃取溴水中的溴,分液时有机层从分液
B.用苯萃取溴水中的溴,分液时有机层从分液
漏斗的下端放出
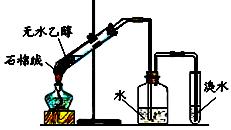
C.实验室用如右图所示装置可制取乙烯并验证
乙烯的某些化学性质
D.鉴别己烯中是否混有少量甲苯,先加足量的
酸性高锰酸钾溶液,然后再加入溴水
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
5.化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.铵态氮肥不能与草木灰混合施用
B.工业上用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏
C.镁合金的硬度和强度均高于纯镁,工业上采用电解MgCl2饱和溶液制得镁
D.MgO 的熔点很高,可用于制作耐高温材料,但工业上不用MgO制镁
4.用NA表示阿伏伽德罗常数的值。下列叙述正确的组合是
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0 .1NA
② 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③ 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
④ 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤ 100 mL
1 mol·L-1 AlCl3溶液中含阳离子数大于0. 1NA
1NA
⑥ 含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA
A.①②⑥ B.②④⑥ C.③⑤⑥ D.①⑤⑥
3.下列有关说法正确的是
A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强
B.H2S加热到300℃时就分解,H2O加热到1000℃才分解,说明O非金属性比S 强
C.将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸,滴加KSCN溶液,出现血红色,说明该试样已变质
D.由ⅠA族和ⅦA族的元素形成的离子晶体,晶体的结构完全相同
2.全氟丙烷(C3F8)是一种高效的温室气体。下列有关全氟丙烷说法不正确的是

A.全氟丙烷的电子式为:
B.相同压强下沸点:C3F8>C3H8
C.C3F8分子中三个碳原子不在同一直线上
D.全氟丙烷分子中既有极性键又有非极性键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com