
1. 据《左传·僖公二十三年》载:“男女同姓,其生不蕃。”《国语·晋语》曰
据《左传·僖公二十三年》载:“男女同姓,其生不蕃。”《国语·晋语》曰 :“同姓不婚,惧不殖生”;“异姓则世德,异德则世类……同姓则同德,同德则同心,同心则同志”。以下对上面“姓”的几则材料理解正确的有
:“同姓不婚,惧不殖生”;“异姓则世德,异德则世类……同姓则同德,同德则同心,同心则同志”。以下对上面“姓”的几则材料理解正确的有
①起到了瓦解宗法制度的作用 ②具有明血缘的作用
③没有认识到近亲繁殖的弊病 ④具有辨别婚姻的作用
A.①② B.②③ C.①④ D.②④
20.(12分)某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:
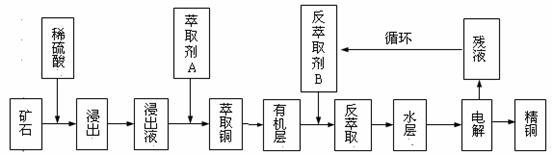
已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式: 。
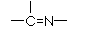 (2)萃取剂A是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个 -CH3、n2个 -OH 和n3个
三种基团,无环状结构,三种基团的数目关系为n3=
。若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是
。
(2)萃取剂A是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个 -CH3、n2个 -OH 和n3个
三种基团,无环状结构,三种基团的数目关系为n3=
。若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是
。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)循环中反萃取剂B的主要成分是 。
(5)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol•L-1H2SO4溶液浸取后,还需加入10mL 1.0mol•L-1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
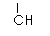
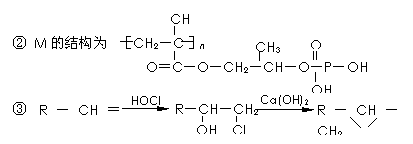
19.(12分)以两种简单烯烃为原料,通过如下方法可合成一种高分子化合物M:
|
|



|
|
|

|

|
|
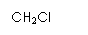

|

|
|
|
|
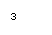

|
|
|
|
|
|



|
|
回答下列问题:
(1)2-甲基丙烯的同分异构体共有 种(含2-甲基丙烯本身,不考虑立体异构)。
(2)反应③、⑥的类型为 、 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为  。
。
(5)请用反应流程图表示A→B的合成线路,并注明反应条件 
(提醒:一定条件下,氧化羟基、醛基的条件足以氧化C=C)。
例:由乙醇合成聚乙烯的反应流程图可表示为:
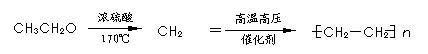
18.(6分)等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的浓硫酸、碱石灰后,浓硫酸与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱有4种峰,峰面积之比为3∶1∶1∶1;
④ 甲、丙、丁、己均能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构简式为 ;己有多种同分异构体,其中一种存在于糖尿病患者的尿液中,写出其结构简式 。
(2)乙、丙、丁三者之间的关系是
 ;
;
丁的结构简式为 。
(3)写出2分子戊生成1分子环状酯的化学方程式 。
17.(8分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 、 。
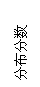
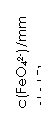
 (2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是
;发生反应的△H 0(填“>”、“<”或“=”)。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是
;发生反应的△H 0(填“>”、“<”或“=”)。

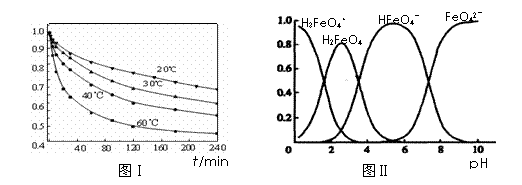
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)高铁酸钾还制作可充电电池,原理为:
 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,
写出该电池充电时阳极电极反应式 。
0.1molCO生成,则10min内反应的平均速率V(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
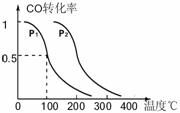 (3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,
CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
16.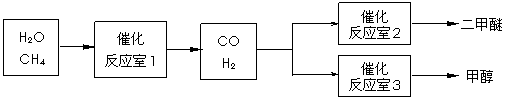 (10分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
(10分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或
“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有
15.(8分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A 、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2:1、1:1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2:1、1:1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)由E、F两种元素组成的化合物1mol跟由A、C、D三种元素组成的化合物的溶液
 发生反应,消耗后者物质的量最大值为 mol。
发生反应,消耗后者物质的量最大值为 mol。
(2)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为 。
(3)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是 。
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的 转化率:Ⅰ=Ⅱ
转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸 收或放出的热量:Ⅰ=Ⅱ
收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极 反应式是
。
反应式是
。
14.(12分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。
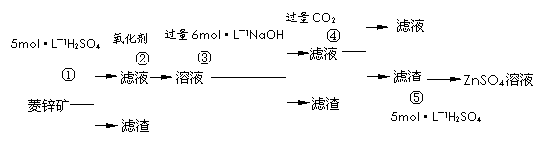
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备
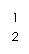 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
C(s)+ -O2(g)=CO(g); △H = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = -460 kJ•mol-1

(4)煅烧还原的热化学方程式为: 。
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) 。
Ⅲ. 制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是 。
12.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
第Ⅱ卷 选择题(共78分)
|
 1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
|
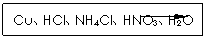 |
|||||
|
|||||
 |
|||||


|
实验药品:铜丝20 g、氯化铵20 g、65% 硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为 ,
用95%乙醇代替蒸馏水洗涤的主要目的是 。
(2)工业化生产时,95%乙醇可通过______方法回收并循环利用,而NH4Cl、_________(填化学式)可直接循环利用。
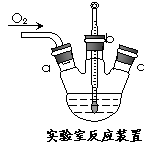
(3)实验室用右上图装置制备CuC1。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择 装置(填字母序号A、B、C)。
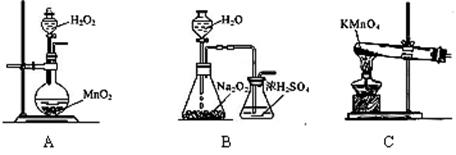

②实验开始时,温度计显示反应液温度低于室温,主要原因是
; 电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿_______(填字母a、b、c)口倾出棕色反应液于1000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿_______(填字母a、b、c)口倾出棕色反应液于1000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com