
19.(2009·理综安徽卷,13)向体积为Va的
18.(2009·理综天津卷,4)下列叙述正确的是( )
A.0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH = 5的CH3COOH溶液和pH = 5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中
c(S2- )下降
17.(2009·理综四川卷,12,)关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
A.c(NH4+ ):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+ )>c(Cl-)>c(OH-)>c(H+)
16.(2009·理综福建卷,10)在一定条件下,Na2CO3溶液存在水解平衡:CO32 -+H2O HCO3- +OH-。下列说法正确的是
( )
HCO3- +OH-。下列说法正确的是
( )
A. 稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,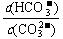 减小
减小
D.加入NaOH固体,溶液pH减小
15.(2009·上海化学卷,17)根据表中提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
|
化学式 |
电离常数 |
|
HClO |
Ki = 3×10-8 |
|
H2CO3 |
Ki1 = 4.3×10-7 |
|
Ki2 = 5.6×10-11 |
A.c(HCO3- )>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3- )>c(H+)
C.c(HClO)+c(ClO-) = c(HCO3- )+c(H2CO3)
D.c(Na+)+c(H+) = c(HCO3- )+c(ClO-)+c(OH-)
14.(2009·理综重庆卷,10)物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
13.(2009·理综天津卷,2,6分)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是 ( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32 -)均增大
11.(2009·广东卷,9,)下列浓度关系正确的是( )
A.氯水中:c(Cl2) = 2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:
c(Na+) = c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32 -)>c(OH-)>c(HCO3- )>c(H+)
12.(2009·理综全国卷II,10)现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。按溶液pH由小到大排列正确的是 ( )
A.④①②⑤⑥③ B.④①②⑥⑤③
C.①④②⑥③⑤ D.①④②③⑥⑤
10.(2009·理综浙江卷,9,6分)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是 ( )
A.0.01 mol·L-1的蔗糖溶液
B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液
D.0.02 mol·L-1的CH3COOH溶液
9.(2009·广东卷,20)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) DH>0
HCOOH(l)+CH3OH(l) DH>0
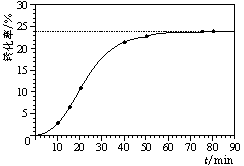
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: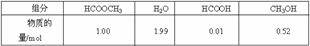 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表: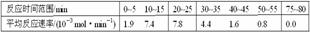 请计算15-20 min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为_________mol·min-1(不要求写出计算过程)。
请计算15-20 min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为_________mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: ___________。
(3)上述反应的平衡常数表达式为:K =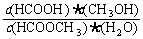 ,则该反应在温度T1下的K值为
。
,则该反应在温度T1下的K值为
。
(4)其他条件不变,仅改变温度为T2(T2大于T1),请在下图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com