
24.答案:B
[解析]A项,由于Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,所以A项错。B项,
NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,c(Mg2+)增大,B项正确。C项,Ksp仅与温度有关,故C项错。D项,虽Mg(OH)2的Ksp较小,但二者的Ksp相近,当c(F-)较大时,仍会出现c(Mg2+)·{c(F-)}2>Ksp[MgF2],从而生成MgF2沉淀,故D错。
23.答案:BC
[解析]平衡常数只与温度有关,与物质的浓度无关,A错误。由图可知,c(SO42 -)相同时,三个不同温度中以313 K的c(Sr2+)最大,所以平衡常数Ksp = c(Sr2+)·c(SO42 -)最大,B正确。从图中数据大小可知:一定温度时线下的点都是浓度偏小,处于不饱和状态所以C项正确;线上的点处于过饱和状态(D项错误:原状态处在363 K线的上方)。
22.答案: AC
[解析]0.01 mol·L-1 NH4HSO4中加NaOH溶液,当1:1与H+反应结束后,由于NH4+ 水解呈酸性,需再加NaOH与NH4+ 反应使溶液呈中性,所以c(Na+)>c(SO42 -)>c(NH4+ ),A项正确。B项中,虽然HCO3- 水解呈碱性,但水解微弱,c(Na+)与c(HCO3- )数值接近,所以c(Na+)>c(HCO3- )>c(OH-)>c(H+),故B项错。C项中把c(H+)移项得:c(OH-) = c(HCO3- )+2c(H2CO3)+c(H+),这是质子守恒,所以C项对。D项,[方法1]由电荷守恒有:c(Na+)+c(H+) = c(CH3COO-)+c(OH-),物料守恒有:2c(Na+) = c(CH3COO-)+c(CH3COOH),两式联立得:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+),因溶液pH = 4.75,即c(H+)>c(OH-),得c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D不正确;[方法2]若溶液呈中性,则有:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+),现呈酸性,即以CH3COOH电离为主,右边增(H+)、减(CH3COOH)值相同,左边增(CH3COO-)值>减小(OH-)值,所以,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D项错。
21.答案:C
[解析]此题可利用电荷守恒,以B项为参照点进行解题:溶液中不可能二种阴离子都多于阳离子(C项错),也不可能二种阴离子都少于阳离子。
20.答案:B
[解析]A、C项实是比较c(H+):①CH3COOH(弱酸性)>③CH3COO-(水解呈弱碱性)>④HCO3- (比CH3COO-水解能力强)>②NaOH(强碱性),即pH为①<③<④<②,所以A、C项错误。
B项比较c(CH3COO-):原条件中都有相同的CH3COO-,①因反应使c(CH3COO-)明显减小,③只存在CH3COO-的水解,②因有NaOH抑制了CH3COO-的水解,④中HCO3- 的水解强于CH3COO-,生成的OH-也抑制了CH3COO-的水解,但比②的抑制作用要弱,所以B项正确。
D项的顺序应与B项相反,即应为:①>③>④>②,D项错。
18.答案:D
[解析]A项,苯酚钠溶液因C6H5O-水解而呈碱性,其离子浓度大小是:c(Na+)>c(C6H5O-)>c(OH-)>c(H+),故A项错。B项,Na2CO3溶液呈碱性,稀释,pH减小,但温度不变,Kw不变,所以B项错。pH = 5即c(H+) = 10-5 mol/L,C项错。根据沉淀溶解平衡,难溶(AgCl)的可以转化为更难溶(Ag2S)的,故D项正确。
19答案: C
[解析]此题以完全反应时为参照点:若Va = Vb,则酸和碱正好完全反应生成CH3COOK,①根据质子守恒:c(CH3COOH)+c(H+) = c(OH-),B项正确;②根据物料守恒:c(CH3COOH)+c(CH3COO-) = c(K+),可判断出:Va>Vb时,即酸过量时,A项正确;③根据电荷守恒(适于各种量变):c(K+)+c(H+) = c(OH-)+c(CH3COO-),可判断出:D项正确、C项错误。
17.答案:B
[解析]本题综合考察强弱电解质的电离、水的电离、盐类水解等有关电离平衡的全部知识。A项,氨水中NH3·H2O是弱碱,电离出的NH4+ 很少,而NH4Cl完全电离,虽然NH4+ 会水解,但水解的部分很少,c(NH4+ ):③>①,A正确。B项,HCl、氨水都是抑制水的电离,浓度相同时,强酸(HCl)对水的抑制作用强于弱碱(NH3·H2O),水电离出的c(H+):①>②,B错。C项,相当于是NH4Cl溶液,选项中等式符合质子守恒,正确。NH4Cl溶液中加入氨水,由于NH3·H2O电离程度大于NH4+ 的水解程度,故D正确。
16.答案: B
[解析]平衡常数仅与温度有关,故稀释时是不变的,A项错。CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确。升温,促进水解,平衡正向移动,故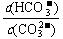 的结果是增大的,C项错。D项,加入NaOH,碱性肯定增强,pH增大,故错。
的结果是增大的,C项错。D项,加入NaOH,碱性肯定增强,pH增大,故错。
[考点分析]此题考查了水解平衡中影响其移动的因素及平衡常数的相关知识。(知识点考察单一但难度有所提升)
15.答案:A
[解析]由电离常数可知电离关系为:H2CO3>HClO>HCO3- ,则同浓度时水解程度为:CO32 ->ClO- >HCO3- 。由于同浓度时,ClO-水解程度大于HCO3- ,A项正确,B项不正确。由物料守恒c(HClO)+ c(ClO-) = c(HCO3- )+c(H2CO3)+c(CO32 -)知,C项不正确。由电荷守恒c(Na+)+c(H+) = c(HCO3- )+c(ClO-)+c(OH-)+2c(CO32 -)知,D项不正确。
14.答案:B
[解析]本题考查同浓度不同溶液酸碱性的比较,重点考查盐类水解规律的灵活应用。KCl、KNO3、Na2SO4均为强酸强碱盐,不水解,溶液显中性,而A中Na2SO3、FeCl3分别水解而使溶液显碱性和酸性;B中由于酸性H2SiO3<H2CO3,根据越弱越水解可判断溶液碱性Na2SiO3>Na2CO3,NH4Cl水解显酸性;C中pH应为:NH3·H2O>Na2SO4>H3PO4>H2SO4;D中NaHCO3水解大于电离而显碱性,C2H5OH对水的电离平衡无影响,pH=7。故只有B项是pH由大到小排列的。
[技巧点拨]比较溶液的酸碱性或pH,首先要判断是酸、碱或盐溶液,一般说来pH:强碱>弱碱,弱酸>强酸;而盐要考虑是否发生水解,盐若不水解pH=7,盐若水解要根据盐中离子性质确定其酸碱性,涉及酸式盐,还要考虑电离和水解程度的相对大小等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com