
5.将淀粉溶液和淀粉酶的混合物放入玻璃纸袋扎好袋口,浸入流动的温水中,经相当一段时后,取袋内液体分别与碘水、新制Cu(OH)2悬浊液(加热)、浓硝酸(微热)作用,其现象依次是
|
试剂 |
A |
B |
C |
D |
|
碘水 |
显蓝色 |
显蓝色 |
无明显现象 |
无明显现象 |
|
新制Cu(OH)2(加热) |
无红色沉淀 |
红色沉淀 |
无红色沉淀 |
红色沉淀 |
|
浓硝酸(微热) |
显黄色 |
无明显现象 |
显黄色 |
无明显现象 |
4.在化学实验室进行下列实验操作时,其操作或记录的数据正确的是( ) A.用托盘天平称取8.84g食盐 B.用250mL的容量瓶配制所需的220mL、0.1mol/L的NaOH溶液 C.用量筒量取12.12mL的盐酸 D.用0.12mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40mL
3.下列各实验现象能用同一原理解释的是( ) A.苯酚、乙烯都能使溴水褪色 B.稀硫酸中加入铜粉不反应,再加硝酸钠或硫酸铁后,铜粉溶解 C.葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀 D.将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,都产生白色沉淀
2.下列实验操作中,仪器需插入液面下的有①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时,测量温度所用的温度计;④用乙醇制乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸 A.③⑤⑥ B.③⑤ C.①②④ D.①②③④⑤⑥
1.下列有关实验操作的叙述中,不正确的是( )
 A.少量的白磷贮存在水中,切割时在水下进行
B.制取硝基苯时,使用的温度计的水银球应浸没于反应混合液中
C.不慎将浓硫酸沾到皮肤上,应迅速大量用水冲洗,最后涂上稀小苏打溶液
D.不能使用裂化汽油从溴水中萃取溴
A.少量的白磷贮存在水中,切割时在水下进行
B.制取硝基苯时,使用的温度计的水银球应浸没于反应混合液中
C.不慎将浓硫酸沾到皮肤上,应迅速大量用水冲洗,最后涂上稀小苏打溶液
D.不能使用裂化汽油从溴水中萃取溴
2.(05年江苏20)硫酸亚铁(FeSO4•7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4•7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗2-3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸吸干晶体;
⑤ 将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存。回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是 。
(2)实验步骤②明显不合理,理由是 。(3)实验步骤④中用少量冰水洗涤晶体,其目的是 ;
。
(4) 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O、FeSO4•H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃时可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4•7H2O |
FeSO4•4H2O |
FeSO4•H2O |
|||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
若需要从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度范围为 。
思维方法: 。
展望高考:
[巩固练习]
课堂反馈
1.(04年江苏19)(1)用已准确称量的1.06克Na2CO3固体配0.100mol/L
Na2CO3溶液100ml,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、
蒸发、结晶、 。
(3) 除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式):
。
思维方法: 。
展望高考:
8.化学实验方案设计题型及解题思路:
(1) 识别与分析评价实验方案:即对实验方法加以评价、或解释某步操作的目的、或推测实验现象等。
解题思路:紧扣题意,明确考查意图,认真分析理解题给信息将其与已有知识结合,形成新知识网络,然后对实验方案进行分析验证。
(2) 设计化学实验方案:用多种装置、仪器、试剂按某种目的进行串联组合完成某项实验。
解题思路:抓住实验目的,明确实验原理,理解各仪器与装置的作用,联想化学原理与物质的有关性质进行解题。基本程序如下:
拆解 根据各小实验原理

 综合实验 若干小实验
确定基本操作及其先后顺序
综合实验 若干小实验
确定基本操作及其先后顺序
[例题解析]
[例1] 实验室常用加热氯酸钾和二氧化锰的混合物来制取氧气,怎样用实验方法证明二氧化锰作催化剂?氯酸钾中含钾、氯,氧三种元素?试设计出实验的简单步骤。
解题思路: 。
易错点: 。
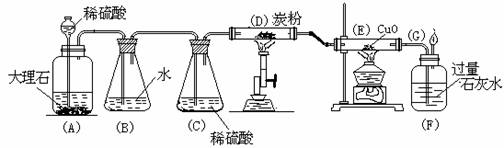
[例2] 为了制取纯净干燥CO2气体,并验证碳、一氧化碳等物质的化学性质,设计了如下实验装置。试根据装置图,回答下列问题:
(1)指出图中选用药品的错误:①_____________②________ _。
(2)把错误改正后,指出在实验过程中,下列几处所见到的现象:
A处:_____________、E处:_____________、F处:_____ _______。
(3)指出下列几处装置的作用:
B处:____________、C处:_____________、F处:_____________。
(4)写出下列几处发生化学反应的方程式:
D处:_____________________、E处: 。
 解题思路:
。
解题思路:
。
易错点: 。
[考题再现]
7.性质实验:根据物质结构特点,设计实验方案探索或验证物质所具有的某些性质。在设计过程中要紧扣实验目的要求,依据实验对象的化学性质(无机物是元素化合物的性质及元素周期律知识,有机物是官能团应具有的性质),抓住本质特征,进行整体思考,设计步骤合理的整体实验方案。
6.
 型物质的实验室制备:(1)选择最佳反应途径:
型物质的实验室制备:(1)选择最佳反应途径:
如用铜制硝酸铜: 。
用铝制氢氧化铝: 。
(2) 选择最佳原料:
如用氯化铝溶液制氢氧化铝: 。
用可溶性铜盐制氢氧化铜: 。
(3)选择适宜操作方法:
如制氢氧化亚铁:
。
(4) 选择适宜收集分离方法:
如制乙酸乙酯: 。
制溴苯: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com