
 (1)溶液的稀释:
(1)溶液的稀释:
①V1p1×W1%= V2p2×W2% 或W液×W1%=(W液+W水)×W2%(溶质的质量守恒)
②C1V1=C2V2(溶质的物质的量守恒)
(2)溶液混合:C V=C2V2+C1V1(溶质的质量守恒)。
[例题解析]
[例1]某无水易溶盐X,摩尔质量为M g/mol,其溶解度为Sg.取其Wg加入VL
蒸馏水,配制成密度为d g/mL,质量百分浓度为A%,物质的量浓度为Cmol/L的澄
清溶液.下式表示正确的是
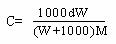
A.1000d×A%=C×M B.
C.S=100W/1000V D.A%=W/(W+1000V)%]
解题思路: 。
易错点: 。
[例2 ]已知98%的浓H2SO4的浓度为18.4mol· L-l,则49%的硫酸溶液的浓度为 ( )
A.等于9.2mol·L-1 B.大于9.2mol·L-1
C.小于9.2mol·L-1 D.不能确定
解题思路: 。
易错点: 。
[考题再现]
1.(03年江苏高考题)质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为( )
A
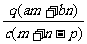 B
B 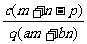
C
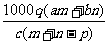 D
D 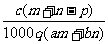
思维方法: 。
展望高考:
|
物理量 |
质量分数 |
物质的量浓度 |
溶解度 |
|
溶质单位 |
|
|
|
|
溶液单位 |
|
|
|
|
单 位 |
|
|
|
|
数值上关系 |
质量分数相同的两溶液其物质的量浓度一般 等. |
物质的量浓度相同的两溶液其质量分数一般 等. |
溶质溶解度相同的两溶液其在同一温度下饱和溶液的质量分数 等. |
|
定
义 |
|
|
|
|
符号 |
|
|
|
|
表达式 |
|
|
|
|
相同点 |
都能示溶质和溶液的相对比值 |
||
|
转化关系 |
|
2.c、 %、ρ之间的计算关系
%、ρ之间的计算关系
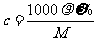
1.物质的量浓度的计算
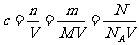
2. 物质的量浓度溶液的配制
(1) 容量瓶
①特点:
②用途: 。容量瓶有各种不同规格,
常用的规格有100mL、250mL、500mL和1000mL等。
(2)配制一定体积物质的量浓度溶液的步骤及所用仪器如下:
(3)配制物质的量浓度溶液时,应注意的问题:
。
1.物质的量浓度
(1)概念:
(2)符号: (3)单位:
(4)说明:①物质的量浓度是溶液的体积浓度
②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种
离子或分子。
10.向某二价金属M的氢氧化物澄清溶液100毫升中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中放出标准状态下的气体4.48升。将滤液加水稀释到250毫升,取出25毫升恰好与20毫升盐酸完全反应,并在标准状态下收集到1.12升气体。
(1)写出M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式
(2)要计算金属M的相对原子质量,你认为还必须提供下列哪项数据?(填标号)
A M的氢氧化物的物质的量的浓度(设为2mol/L)
B M的碳酸盐的质量(设为39.4克)
C 与M的碳酸盐反应的盐酸的物质的量浓度
D 题给条件充足,不需要补充数据
(3)根据你的选择计算金属M的相对原子质量和加入NaHCO3溶液中NaHCO3的质量
9.在天平的两个托盘上各放一个盛有等体积稀硫酸的烧杯(每杯溶液中都含有mmol的H2SO4),调节天平使其平衡。然后在一个烧杯中加入ag铁粉,在另一个烧杯中加入bg镁粉,充分反应后,天平仍平衡。试用代数式表示在下列各种情况下,a与b的关系(关系式中可含m)。
①若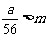 ,
,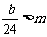 时,___________________________。
时,___________________________。
②若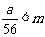 ,
,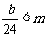 时,___________________________。
时,___________________________。
③若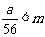 ,
,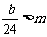 时,___________________________。
时,___________________________。
8. 用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体的平均式量为19,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为( )
A. 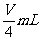 B.
B.
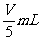 C.
C.
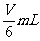 D.
无法判断
D.
无法判断
7.P和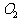 放在两容器中,控制不同条件,分别发生:
放在两容器中,控制不同条件,分别发生: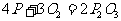 (容器1),
(容器1),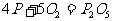 (容器2),若在两容器中分别放1mol
P和1mol
(容器2),若在两容器中分别放1mol
P和1mol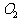 ,充分反应后得到
,充分反应后得到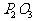 和
和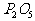 的物质的量之比是
( )
的物质的量之比是
( )
A. 1:1 B. 5:4 C. 4:3 D. 5:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com