
5.答案:(1)bc(2)b(3)94.7%(4)10.5g
[解析]本题主要考察平衡的基本计算及平衡状态的判断。(1)平衡状态的特征是各组分含量保持不变和VB(正)=VB(逆),所以b正确,a、d错误,由于左右两边计量数不等,所以压强不变也说明是平衡态,而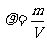 ,气体质量守恒,容器体积又不百年,所以
,气体质量守恒,容器体积又不百年,所以 始终不变;(2)欲提高转化率,即促使平衡右移,冲入N2无影响,冲入O2平衡右移,催化剂只改变反应速率,对平衡无影响,升高温度,平衡左移动,所以选b;
始终不变;(2)欲提高转化率,即促使平衡右移,冲入N2无影响,冲入O2平衡右移,催化剂只改变反应速率,对平衡无影响,升高温度,平衡左移动,所以选b;
(3)消耗氧气的物质的量:
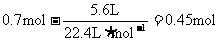
生成SO3的物质的量:

SO2和SO3的物质的量之和:
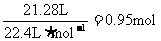
反应前SO2的物质的量:0.95mol
SO2的转化率:
(4)在给定的条件下,溶液呈强酸性,不会生成BaSO3。因此BaSO4的质量:
4.答案:(1)S+H2 ====== H2S
(2)H2SO3+2H2S===3S↓+3H2O
|
(3)2H2SO4(浓)+C=====CO2↑+2SO2↑+2H2O
(1分)(其他合理答案也给分)
(4)①H2SO4+2OH-===SO32-+2H2O(1分)
②大于 Na2SO3是弱酸强碱盐,水解后溶液呈碱性(2分)
③增大 水解是吸热反应,加热促使SO32-水解程度增大,因而pH增大(2分)
[解析]由题意及设问可知,A是非金属元素单质,且能与H2在加热的条件下反映,生成的氢化物有还原性,可知是变价元素。B和C是A的两种氧化物且B和C的相对分子质量之比为4:5,由此可推出A是S,B是SO2,C是SO3,D是H2SO4(浓),E是H2SO3。
3.答案:(1)Cu、O(2)be
(3)2Fe3++2I-===2Fe2++I2
S2O82-+2Fe2+===2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a.Al3++4OH-===AlO2-+2H2O
[或Al3++4OH-===Al(OH)4-]
b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色。
[解析](1)在CuFeS2中Cu的化合价为+2,S的化合价为-2,反映中化合价降低的元素是Cu、O,发生还原反应。
(2)SO2的吸收(c)和SO2的利用(b)
(3)根据催化剂的特点分析。Fe3+有氧化性,能氧化I-,Fe2+具有还原性可被S2O82-氧化。
(4)Al3+能与过量的NaOH反应,生成可溶性的NaAlO2 [或NaAl(OH)4]。Fe2+具有还原性,能被KMnO4氧化,从而使KMnO4溶液褪色
2.答案:
[解析]BD从信息中可看出NO2在转化过程中既有氧化剂的作用(①中),又有催化剂的作用(整体看)。
1.答案: A
[解析]O2和O3是同素异形体,不是同位素;O3中氧原子和氧原子之间存在共价键,H2O2中氢原子之间,氧原子与氧原子之间都存在共价键
9.(2009上海化学30)(5分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为_________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为__________。
高考真题答案与解析
化 学
[考点18]硫的氧化物 硫酸及氧族元素
8.(2009·理综全国卷I,27)(15分)浓H2SO4和木炭在加热时发生反应的化学方程式是:2H2SO4(浓)+C CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
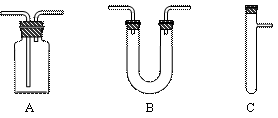
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
|
|
|
7.(2009上海化学26)(12分)根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
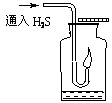
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器:_______(填编号)。

(3)如图,在一个充满氧气的集气瓶中加入少量品红稀溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是___________________。
(4)在上述集气瓶中继续通入 硫化氢气体,振荡,发生反应的化学方程式为:
___________________
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。


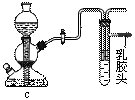
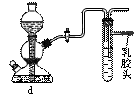
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
6.(2009上海理综15)(3分)右图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含( )
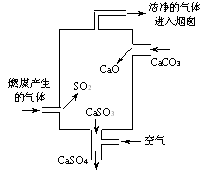 A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
5.(2008江苏化学20)(10分)将一定量的SO和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
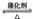 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com