
5.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是( )
A.Ca2+、AlO2-、SO42-、Cl- B.K+、Na+、ClO-、Cl-
C.Na+、Fe2+、NO3-、SO42- D.NH4+、Na+、F-、CO32-
4. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 ( )
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)> c(OH-)>c(H+) 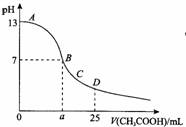
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
3. 把三氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.无水三氯化铁 B.氢氧化铁 C. 氧化亚铁 D.三氧化二铁
2.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A. c(NH4+)==c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(OH-)+c(SO42-)==c(H+)+c(NH4+)
1. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
9.答案:(1)35.6。 (2)3。 (3)0.5。
[解析](1)假设有10 mol O2,有3 mol O2反应生成2 mol O3,则混合气体为7 mol O2和2 mol O3。所以,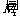 =
= 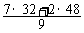 = 35.6。或根据质量守恒
= 35.6。或根据质量守恒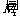 =
= 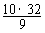 = 35.6。
= 35.6。
(2)可根据气体体积差量法计算
3O2 2O3
DV
2O3
DV
3 2 1
V(O3) (8-6.5) L 得V(O3) = 3 L
(3)n(混合气) =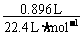 = 0.04 mol;
= 0.04 mol;
n(Cu) =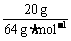 = 0.31 mol;
= 0.31 mol;
Cu过量,所以粉末增加的质量即为混合气体的质量。
所以有:0.04 mol×j(O3)×48 g·mol-1+0.04 mol×[1-j(O3)]×32 g·mol-1 = 1.6 g
解得j(O3) = 0.5
8.答案:C
[解析]浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 品红 检验SO2是否除尽 [注]原答案中无此过程
A 澄清石灰水 检验CO2的存在。
[解析]成套装置通常包括反应装置、检验装置和尾气处理装置,但此题中的有毒气体在前些步骤中已除去,所以不再需要尾气处理。
思路:应先发生C与浓硫酸的反应,选C;三种产物中,检验SO2、CO2都要在溶液中,所以要先检验H2O,选B(装CuSO4);SO2、CO2都能使石灰水变浑浊,应先检验SO2,选A(品红);接着,除去SO2(用KMnO4)后,再检验CO2。
7.答案:(1)ad。 (2)②③④。
(3)品红溶液褪色;瓶壁有淡黄色粉末和无色的小液滴。
(4)SO2+2H2S = 3S↓+2H2O 变大。
(5)b。 (6)S H2O。
[解析](1)启普发生器制取气体,试剂应选用块状固体(排除c)和液体,且反应不需要加热,故a、d正确。由于硝酸能氧化-2价硫而得不到H2S,所以b项错。
(2)欲控制反应速率,需要控制滴加液体的流速,故要用分液漏斗;若用试管⑤,需要导管(现无),所以用试管④。
(3)此问易回答不完整。要先理解反应过程:开始时氧气足量,H2S燃烧生成SO2和H2O;后来氧气不足, 燃烧产物为S和H2O。根据反应过程描述反应现象时,通常要从固、液、气三态来分别考虑其颜色、气 味、光、热等等,以防漏答。此处只要求瓶内的现象,所以可不考虑气味。
(5)右部增加的装置为燃烧安全瓶,当安全瓶内燃烧时,乳胶头体积增大,起到减小瓶内压强的作用;这要求安全瓶内的气体与左部反应装置的气体不能相通,所以a错、b对。c、d是排液装置,生成的H2S无法排出,故错误。
(6)设空气为100,V(H2S) = 30,V(O2) = 70× = 14,O2不足,所以发生反应2H2S+O2
= 14,O2不足,所以发生反应2H2S+O2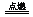 2S+2H2O。
2S+2H2O。
6.答案:C
[解析]装置中涉及到的化学方程式依次为CaCO3 CaO+CO2↑,SO2+CaO = CaSO3,2CaSO3+O2
CaO+CO2↑,SO2+CaO = CaSO3,2CaSO3+O2 2CaSO4,无置换反应。
2CaSO4,无置换反应。
0.90mol×0.05×233g·mol-1≈10.5g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com