
18.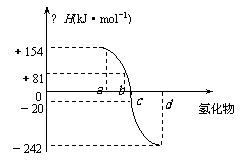 (6分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
(6分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
(1)写出氧族元素中含有18e-的两种氢化物的电子式 。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
。
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
。
17.(10分)(1)在下表用粗实线划出金属元素与非金属元素的分界线。

 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素周期表是学习化学的重要工具,它含有许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/m |
0.16 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
用元素代号在表(1)中的标出它们的周期表中对应位置
(4)上述A、B、E所代表元素的离子半径最大的为 (填离子符号)
(5)周期表有些元素存在“对角线相似”现象,请写出D的单质与强碱溶液反应的离子方程式 。
16.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B和E的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个离子反应方程式 。
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式 。
15.X、Y两种元素的原子,当它们分别获得一个电子后,都形成稀有气体原子的电子层结构,且X放出的能量大于Y,下列叙述正确的是
A.X-的还原性大于Y-
B.Y的氧化性大于X
C.X的原子序数小于Y
D.X-的原子半径小于Y-
班别___________ 姓名____________ 座号 ____________ 评分 __________
14.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径由小到大的顺序为:W<X<Y<Z
C.X与W可以形成W2X、W2X2两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
13.下列有关物质的结构或性质的叙述错误的是
A.H3BO3、H2CO3、HNO3的酸性逐渐增加
B.BeSO4、MgSO4、CaSO4、BaSO4的溶解性逐渐减弱
C.S2-、Cl-、K+、Ca2+的离子半径依次增大
D.NH3、PH3的水溶性依次降低
12.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>b B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
11.有X、Y、Z三种同主族元素,已知最高价氧化物的水化物的酸性强弱顺序是:
H3XO4<H3YO4<H3ZO4。下列推断正确的是
A.元素的非金属性:X>Y>Z
B.原子序数:X>Y>Z
C.气态氢化物的稳定性:XH3>YH3>ZH3
D.气态氢化物的还原性:XH3>YH3>ZH3
10.下列物质按沸点降低的顺序排列的是
A.CI4、CBr4、CCl4、CF4 B.石英、食盐、干冰、钾
C.HI、HBr、HC1、HF D.Li、Na、Mg、Al
9.已知钍 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ,下列对生成物X的推断错误的是
,下列对生成物X的推断错误的是
A.X的氢氧化物是一种强碱 B.X的碳酸正盐不溶于水
C.X原子核外有6个电子层 D.X的最高化合价为+2价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com