
14.(10分) -锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以 -锂辉石为原料制备碳酸锂的一种流程如下:
-锂辉石为原料制备碳酸锂的一种流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原
因是 。
13.(12分)黄铁矿的主要成分是 。测定黄铁矿中
。测定黄铁矿中 含量的两种方法如下图所示:
含量的两种方法如下图所示:

|
|
 王水
方法I
王水
方法I

滤液
黄铁矿 足量BaCl2溶液
|
干燥、称重
已知:
请回答下列问题:
(1)方法I中灼烧滤渣用的仪器除酒精灯、三角架、还有 。
(2)方法II中加足量 溶液的作用是 ,判断加入
溶液的作用是 ,判断加入 溶液已过量的操作是
溶液已过量的操作是
。
(3)用方法I测定黄铁矿试样中 的含量,发现测定结果总是偏高,则产生误差的可能原因是:①
;② 。(测定过程中由操作产生的误差可忽略。)
的含量,发现测定结果总是偏高,则产生误差的可能原因是:①
;② 。(测定过程中由操作产生的误差可忽略。)
(4)称取黄铁矿试样1.60g,用方法II进行测定,称得干燥后的滤渣质量为1.66g,假
设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是 。
12.25℃时,下列溶液中微粒的物质的量浓度关系正确的是
A. 的
的 与
与 混合溶液中:
混合溶液中:
B.0.1 的KHA溶液,其
的KHA溶液,其
C.20mL 0.1 醋酸钠溶液与10mL 0.1
醋酸钠溶液与10mL 0.1 盐酸混合后的溶液中:
盐酸混合后的溶液中:


D.在25mL 0.1 
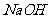 溶液中逐滴加入0.2
溶液中逐滴加入0.2
 溶液,溶液pH变化如右图所示,在A、B间
溶液,溶液pH变化如右图所示,在A、B间
任一点,溶液中一定都存在下列关系:

非选择题
11.芬兰籍华人科学家张霞昌研制的“超薄型软电池”或2009年中国科技创业大赛最高奖,被称之为“软电池”的纸质电池总反应为: 。下列说法正确的是
。下列说法正确的是
A.该电池中 作负极,发生还原反应
作负极,发生还原反应
B.该电池反应中 起催化作用
起催化作用
C.该电池工作时电流由 经导线流向
经导线流向
D.该电池正极反应式为:
10.某药物分子结构简式如下图所示,下列关于该物质的说法正确的是

A. 分子式为
B. 醚键上的氧原子至少与另外11个原子共面
C. 分子中不存在手性碳原子
D.在一定条件下可发生加成、取代、氧化反应
9.设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
A.
 和
和 组成的混合物中含有中子数是
组成的混合物中含有中子数是
B.

 (分子结构如右图所示)中含有的N-N键数目为1.5
(分子结构如右图所示)中含有的N-N键数目为1.5
C.0℃、1.01×10 时,11.2L氧气中所含的原子数为
时,11.2L氧气中所含的原子数为
D.常温下,将5.6g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3
8.下列离子方程式正确的是
A. 溶液中滴加
溶液中滴加 溶液:
溶液:
B. 溶液中加入足量的氨水:
溶液中加入足量的氨水:
C. 溶液中加入
溶液中加入 溶液至溶液呈中性:
溶液至溶液呈中性:

D.向
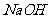 溶液中通入224
溶液中通入224 (标准状况)
(标准状况)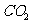 ;
;


7.下列实验结论正确的是
 A.将饱和氯水滴到淀粉碘化钾试纸上出现如右图所示现象,说明氯水能将
A.将饱和氯水滴到淀粉碘化钾试纸上出现如右图所示现象,说明氯水能将 氧化成
氧化成 ,还能将
,还能将 进一步氧化成碘的化合物。
进一步氧化成碘的化合物。
B.将过量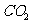 通入
通入 溶液中,最后得到澄清溶液,说明
溶液中,最后得到澄清溶液,说明 的酸性比
的酸性比 弱
弱
C.向某溶液中加入新制 ,加热,出现红色沉淀,说明该溶液中一定含醛类物质
,加热,出现红色沉淀,说明该溶液中一定含醛类物质
D.向苯酚溶液中滴加少量稀溴水,溶液中没有沉淀生成,说明溶液中二者不能发生反应
6.A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B与F同主族,E与F同周期,已知常温下A、E单质的状态不同,D原子的核电荷数是B原子最外层电子数的2倍,F单质是一种重要的半导体材料。下列说法正确的是
A.原子半径由达到小的顺序是:
B.由A、C、D三种元素组成的化合物中可能含有离子键
C.F、C、B元素最高价氧化物对应的水化物的酸性依次增强
D.F与D形成的化合物质地坚硬,既不与酸反应也不与碱反应
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题得0分;若正确答案包括两个选项,另选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
5.在制定环境中,下列各组离子可以大量共存的是
A.无色溶液中: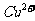 、
、 、
、 、
、
B.滴加酚酞试液呈无色的溶液中: 、
、 、
、 、
、
C.在 的溶液中:
的溶液中: 、
、 、
、 、
、
D. 的溶液中:
的溶液中: 、
、 、
、 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com