
例1.某些化学试剂可用于净水。水处理中使用一种无机高分子,化学式为[Al2(OH)n Clm·yHO]x,式中m等于( )
A.3-n B.6-n C.6+n D.3+n
解析:由电荷守恒有:3n(Al3+)=n(OH-)+m(Cl-)
即3×2=n+m m =6-n
例2.非整数比化合物Fe0. 95O具有NaCl晶体结构,由于n(Fe):n(O)<1,
所以晶体结构存在缺陷,在Fe0. 95O中,+3价的Fe占总铁量的( )。
A.10.0% B. 85.0% C. 10.5% D. 89.50%
解析:设+3价铁为x mol,依电荷守恒有:3n(Fe3+) + 2n(Fe2+) = 2n(O2-)
即:3x + 2(0.95-x)= 2×1 x=0.1
+3价的Fe占总铁量的0.1/0.95×100% = 10.5%
例3.将K2SO4和Al2(SO4)3和KAl(SO4)2三种溶液混合,加H2SO4酸化。测得c(SO42-)=0.105 mol/L,
c(Al3+)=0.055 mol,pH=2.0(假设H2SO4完全电离为H+ 和SO42-),则c(K+)为( )。
A. 0.045 mol/L B. 0.035 mol/L C. 0.055 mol/L D. 0.040 mol/L
解析:因pH=2.0所以c(H+)= 0.01 mol/L,c(OH-)很小,忽略不计。根据电荷守恒有:c(K+)+ 3c(Al3+)+c(H+)= 2c(SO42-) 解之:c(K+)=0.035 mol/L
例4.现有K2SO4和Al2(SO4)3和KAl(SO4)2的混合溶液,其中n(SO42-)=2 mol,向混合溶液逐滴加入KOH,使生成的沉淀刚好完全溶解时,消耗2 mol KOH溶液,求原溶液中的K+ 的物质的量?
解析:生成的沉淀刚好完全溶解时,消耗2 mol KOH溶液,由反应
Al3+ + 4OH- = AlO2- + 2H2O n(Al3+)=n(OH-)/4=0.5 mol
设原溶液中的K+的物质的量为n(K+原),由电荷守恒,对原溶液有
n(K+原)+ 3n(Al3+) = 2n(SO42-)①
加入2 mol KOH溶液后,由电荷守恒有:
n(K+原)+ n(K+加入)= n(AlO2-) + 2n(SO42-)②
由Al元素守恒有:n(Al3+) = n(AlO2-) ③
联立①②③解得:n(K+原)=2.5 mol
例1.向100 mL水中投入K和Al共15 g,充分反应后,剩余金属为1.8 g
(1)计算放出H2多少升(标准状况下)
分析:剩余金属1.8 g只可能是Al(因钾要与水反应),钾与水反应生成KOH和H2,KOH再与Al反应(因金属Al有剩余,所以生成的KOH完全反应),
2K+2H2O=2KOH+H2↑①
2KOH+ 2H2O + 2Al = 2NaAlO2 + 3H2 ↑ ②
①+②得:2K + 2Al+ 4H2O = 2NaAlO2 + 4H2 ↑
有关系式 金属质量 --- 氢气体积(标准状况下)
66 g 44.8 L
15-1.8 V(H2)=8.96 L
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L的H2SO4溶液,生成沉淀的最大值是多少,此时消耗H2SO4溶液的体积是多少?
解析:据Al守恒有关系式:Al---Al(OH)3可计算生成沉淀的质量。 要使生成的沉淀最多,Al3+全部生成Al(OH)3沉淀,溶液中溶质只含K2SO4溶质,据K+与SO42-守恒有关系式:
2 K --- H2SO4
2 mol 1 mol
0.2 mol 4×V(H2SO4)
V(H2SO4)=25 mL
(3)生成沉淀后,再加入H2SO4溶液,使沉淀刚好完全溶解,此时消耗H2SO4溶液的体积是多少?
解析:沉淀刚好完全溶解时,溶液中只有K2SO4和Al2(SO4)3。
由电荷守恒有:2n(SO42-)=3n(Al3+)+n(K+)
所以有n(H2SO4 )=3/ n(Al)+1/2n(K)答案为100 mL
例2.将5.1 g镁和铝投入500 mL,2 mol/L的盐酸中,生成氢气0.5 g,金属完全溶解。再加入4 mol/L的NaOH溶液。
(1)若要使生成的沉淀最多,则应加入NaOH溶液的体积是( )。
A . 20 0mL B . 250 mL C. 425 mL D. 560 mL
分析:要使生成的沉淀最多,Mg2+和Al3+全部生成Mg(OH)2和Al(OH)3沉淀,溶液中溶质只含NaCl,据Na+ 与Cl- 守恒有:
500×2=4×V(NaOH)
所以V(NaOH)=250 mL
(2)生成沉淀的质量最多是( )。
A. 22.1 g B. 8.5 g C. 10.2 g D. 13.6 g
分析:从始态(金属镁和铝)到终态(Mg(OH)2和Al(OH)3)沉淀,固体增加的质量为OH-的质量,只要计算出OH- 的物质的量即可,而OH- 的物质的量等于反应中转移的电子的物质的量,因反应中生成氢气0.5 g,所以转移的电子的物质的量为氢气物质的量的2倍,即0.5 mol e质量,答案为D。
7、“不定体系”,如“NO和O2的混合气”、“NO2气体有时应考虑2 NO2 (g)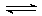 N2O4 (g)”等。
N2O4 (g)”等。
例1 设NA表示阿伏加德罗常数。下列叙述正确的是( )
A.标准状况下,2.24 L苯中含有0.6NA个碳原子
B.常温常压下,46gNO2和N2O4混合气体中含有原子数为3NA
C.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.1NA
D.0.01mol铝与足量的氢氧化钠溶液反应转移的电子数是0.03NA
解析 标准状况下苯为液态,不能使用气体摩尔体积“22.4L/mol”进行计算;根据质量守恒定律,46gNO2和N2O4混合气体中含有原子数为3NA(注意若求分子数则不能确定);因Mg2+在水溶液中发生水解,故Mg2+数小于0.1NA;铝为三价金属,则0.01mol铝与足量的氢氧化钠溶液反应转移的电子数是0.03NA。本题答案选BD。
例2 设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.1 mol Na2O2与足量的水反应,转移的电子数为2NA
 C.NA 个SO3分子在标准状况下的体积为22.4
L
C.NA 个SO3分子在标准状况下的体积为22.4
L
D.常温常压下,62g白磷分子( )中的共价键数为3NA
解析 20 g D2O物质的量为1mol,根据关系式 2 D2O ~ D2可求得生成气体分子数为0.5 NA; Na2O2与H2O的反应中,1 mol Na2O2转移电子数为NA;标准状况下SO3为固态,不能使用气体摩尔体积“22.4L/mol”进行计算;1 mol 白磷中含6 mol P-P共价键,则62g(0.5mol)白磷分子中的P-P共价键数为3NA。本题答案选AD。
6、“特殊物质”的处理:特别物质的摩尔质量。如:D2O、T2O、18O2、14CO2等。例“18g重水(D2O)含有10NA个电子”,其错误在于认为其式量为18,。
5、电离、水解等常识:考查知识点多以弱电解质电离、盐类的水解等引起微粒数目的改变,如含1molNa2CO3的溶液中有NA个CO32-、1molFeCl3完全水解生成NA个Fe(OH)3胶粒,以上说法错误在于忽视了CO32-水解及胶粒的组成特点。
4、氧化还原反应:较复杂的氧化还原反应中,求算转移的电子数。如:Na2O2+H2O→,Cl2+NaOH→,NO2+H2O→,电解Cu(NO3)2溶液等。
3、物质结构:考查内容多涉及一定物质的量的物质中含有多少粒子(分子、原子、电子、质子、中子、离子等)化学键数目(如SiO2、Si、P4、CO2)等等,常考物质的化学键如下:1 mol 金刚石中含2 mol C-C共价键,1 mol石墨中含1.5 mol C-C共价键,1 mol 晶体硅中含2 mol Si-Si共价键,1 mol SiO2中含4 mol Si-O共价键,1 mol CH4中含4 mol
C-H共价键,1 mol 白磷中含6 mol P-P共价键,1 mol CO2中含2 mol C=O双键。
2、物质状态:考查气体摩尔体积时,常用标准状况下非气态的物质来迷惑学生,水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;在标准状况下,碳原子数大于4而小于16的烃为液态(新戊烷除外),大于或等于16的烃为固态;在标准状况下,乙醇、四氯化碳、氯仿、苯、二硫化碳等许多有机物都不是气态。
1、状况条件:考查气体时,一定要特别关注是标准状况下还是非标准状况。如“电解饱和硫酸铜溶液,若在阳极产生11.2L气体,则电子转移为2NA”。判断该说法正误时易认为相关反应为:2CuSO4+2H2O=2Cu+2H2SO4+O2↑,生成1molO2转移4电子,若生成0.5molO2即11.2L,则电子转移为2NA,其分析错误在于该题未指明标准状况下。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com