
8.答案:A
[解析]除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成份。溶液中可用这样的方法: Na2CO3 + H2O + CO2 = 2NaHCO3。
7.答案:D
[解析]A项生理盐水的浓度大概为0.1538 mol.L-1所以A项错误。B项铜绿主要成分为碱式碳酸铜;C项根据合金的特性①硬度比其成分强,②熔点比其成分低判断C项错误。
[考点分析]金属及其化合物的综合应用
6.答案: B
[解析] A. 钠在空气中燃烧生成Na2O2而非Na2O;B. 具有重键的有机物和苯的同系物都可以使高锰酸钾溶液褪色;C. CO2在常温下是气态,为分子晶体,低熔沸点;而SiO2在常温下是固态,为原
子晶体,高熔沸点;D. C60是分子晶体,硬度小;而金刚石是原子晶体,硬度大。
5.答案:D
[考点]本题考查了海水制备无水氯化镁的步骤。
[解析]本题是由海水制备无水氯化镁,主要步骤是先将海水中的成分氯化镁转变为氢氧化镁即②步为第一步骤,④过滤,得到氢氧化镁,再用③加盐酸的方法,将其变为氯化镁溶液,浓缩结晶,在一定条件下脱水干燥即可得到无水氯化镁。
4.答案:A
[考点]本题考查了盐的水解规律。
[解析]氯化铵是强酸弱碱盐,水解,显酸性。相当于发生Mg+2H+=Mg2++H2↑ ,而其他溶液均显碱性。所以选A。
3.答案:A
[考点]本题考查了化学反应实验现象的描述。
[解析]氢气在氯气中燃烧生成苍白色火焰,有白雾生成,A错。
2.答案:C
[解析]此题考查化学实验基本操作规范性。A要吸干表面的煤油再切,B中容量瓶不能配制溶液,D中分液时下层液体从下口放出,上层液体从上口倒出。
14.(2009理综全国卷I,11)(6分)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.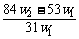 B.
B.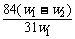 C.
C.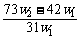 D.
D.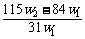
高考真题答案与解析
化 学
[考点14]钠及其化合物
|
Fe(OH)3、CaCO3。
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
(3) 若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
(4) 若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl -,SO42-,OH -,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
(5) 写出Na2CO3·H2O脱水反应的热化学方程
Na2CO3·H2O(S)==== Na2CO3(s) + H2O(g) H= +58.73kJ/mol
[解析]
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(S)==== Na2CO3(s)+ H2O(g)。
13.(2009理综全国卷II8)(6分)下列叙述中正确的是 ( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成。
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2.
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有结晶析出
12.(2009上海化学10)(3分) 9.2 g金属钠投入到足量的重水中,则产生的气体中含有 ( )
A.0.2 mol中子 B.0.4 mol电子
C.0.2 mol质子 D.0.4 mol分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com