
1.下列词语中,加点字注音错误最多的一项是 ( )
A.镜奁(lián) 不怿(yì) 博闻强识(zhì) 模棱两可(líng)
B.曩者(nǎng) 伺候(sì) 大模大样(mó) 矫揉造作(jiǒo)
C.倨傲(jū) 驽马(nǔ) 刎颈之交(jìng) 人影幢幢(zhuàng)
D.颧骨(quán) 缧绁(léi) 煞有介事(shā) 简明扼要(é)
23.取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出
气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(1)当加入196g稀硫酸时,放出气体的质量为 g。
(2)计算加入的稀硫酸溶液溶质的质量分数为 。
(3)试通过计算求出加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数。(写出计算过程)


答案:(1)4.4(2分);(2)10%(2分)
(3)(3分)解:设Na2CO3样品质量为X,反应生成Na2SO4的质量为y
Na2CO3+ H2SO4 Na2SO4 + H2O + CO2↑
106 142 44
X y 4.4g
则:106g×4.4g = 44x 解得:X=10.6g
142×4.4g = 44y 解得:Y=14.2g
溶液的溶质质量分数为: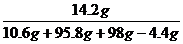 ×100% =
7.1%
×100% =
7.1%
答:此时该溶质的质量分数为7.1%。
22.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们用 NaOH溶液来清洗硫酸。若要清洗100 kg这种石油产品,理论上需NaOH kg。
石化厂现进行了技术改造,改用Ca(OH)2。中和这些残余硫酸。已知市场价格:NaOH为24元/kg,Ca(OH)2:为6元/kg,那么每处理100 kg这种产品,可以节约多少经费? (写出必要的计算过程)
解:设改进后需要Ca(OH)2的质量为y
Ca(OH)2+H2S04==CaSO4+2H2O
74 98
y 100 kg x4.9%
y=4 kg
(1分)
可以节约经费:(4 kg x 24元/kg)-(3.7 kg×6元/kg)=73.8元(1分) 。
答:略
20.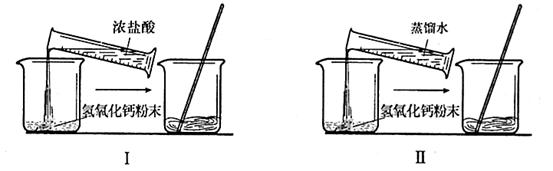 小明在“探究盐酸和氢氧化钙能否发生化学反应”时,设计了如图所示的对照实验:
小明在“探究盐酸和氢氧化钙能否发生化学反应”时,设计了如图所示的对照实验:
他设想在室温下,先取少量氢氧化钙粉末分别放人两只烧杯中,在Ⅱ烧杯中加入一定量的蒸馏水,在I烧杯中加人含等量蒸馏水的浓盐酸,充分搅拌,一段时间后,观察现象。
根据上述情况,请回答以下问题:
(1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中_________________________完全相同。预测通过观察_______________________________________的现象,说明盐酸和氢氧化钙发生了化学反应;
(2)设计对照实验Ⅱ的目的是___________________________________________:
(3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生化学反应:____________________________________________________________________;
(4)写出该反应的化学方程式______________________________________;
(1)氢氧化钙粉末的质量
实验I中白色粉末消失成为无色溶液或实验I中的浑浊程度比实验Ⅱ中小
(2)排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应
(3)在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应
(4)Ca(OH)2+2HCI=CaCl2+2H20
19.某化学活动小组以“酸碱盐的性质”为主题,进行探究学习,请你做为该小组成员来解决下列问题:
(1)小刚同学说:“酸溶液呈酸性,碱溶液呈碱性,则盐溶液一定呈中性”。你认为这种推理 (填“正确”或“不正确”),你的例证是 。
(2)小丽同学从某一欠收农田里取回一份土壤样品,请你用两种不同的方法帮小丽测出该土壤样品浸出液的酸碱性(只写出所用物品的名称即可):
① ;② 。
如果检测的结果呈酸性,那么要改良此土壤,应该向农田里施加 。
(3)请你设计一个实验,能通过清晰可见的现象,除去氯化钙溶液中的少量稀盐酸。你的实验方案是(写出实验操作、现象和结论):
(1)不正确 碳酸钠是盐,但水溶液呈碱性
(2)PH试纸 紫色石蕊试液 熟石灰
(3)往溶液中加过量的碳酸钙,会产生气泡。CaCO3+2HCl=CaCl2+H2O+CO2↑,当不再产生气泡时,将溶液过滤,滤液中就不含有稀盐酸了。
18.中考前,沈阳市对初中毕业生进行了实验操作考查,小翔抽到的题签是:检验溶液的酸碱性。他选择紫色石蕊试液完成了这个实验。一直喜欢科学探究的他在得知成绩合格后,立即向老师询问,知道了样品1为稀氯化钠溶液,样品2为稀盐酸,样品3是稀碳酸钠溶液。细心的小翔还发现自己废液缸里的废液呈现红色。请你帮他分析:
(1)废液里一定含有的物质是 、 (石蕊试液和水不填)。
(2)废液呈现红色的可能原因是 (从实验前配制样品或小翔实验操作的角度分析,答一点即可)。
(1)HCl NaCl (2)盐酸溶液的溶质质量分数大(或盐酸加多了)
18.化学与人类的生活和生产有着密切的关系。
(1)请你用化学方程式表示生活或生产中的下列事实:
①在通风不畅的室内使用煤炉时,会产生有毒气体:
____________________________;
②胃酸过多的病人常服用含氢氧化铝的药物:
____________________________;
③工业上常用一氧化碳从赤铁矿(主要成分为Fe2O3)中把铁还原出来:
____________________________。
(2)以上反应属于复分解反应的是(填序号)____。
(4分,每空1分)(1)① ②
②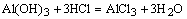 ③
③ (2)②
(2)②
17.从熟石灰、一氧化碳、汽油、浓硫酸、硫磺、合成纤维中选择符合下列用途的物质,将其名称或化学式填入相应的空格内。
(1)干燥剂 ; (2)冶炼金属 ;
(3)有机溶剂 ; (4)处理酸性污水 。
⑴浓硫酸 ⑵一氧化碳 ⑶汽油 ⑷熟石灰
15.请用化学方程式表示下列化工生产中的变化:
(1)生石灰制熟石灰 ; (2)一氧化碳还原氧化铁 ;
(3)用烧碱溶液吸收二氧化硫 ;
(4)铝和二氧化锰在高温条件下反应制造金属锰,同时生成另一种氧化物 。
(1)CaO+H2O=Ca(OH)2 (2)3CO+Fe2O3高温2Fe+3CO2
(3)2NaOH+SO2===Na2SO3+H2O (4)4Al+3MnO2高温3Mn+2Al2O3
16.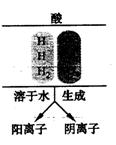 根据信息回答下列问题:
根据信息回答下列问题:
(1)右图中三种酸溶于水时生成的阳离子全部是 ;
(2)由右图中可推测出,它们具有相似的化学性质。请写出氢溴酸(HBr)与Ca(OH)2溶液反应的化学方程式为 ;
(3)依据一定的分类标准,可将这三种酸划分为两组:一组是HCl和HBr,另一组只有H2SO4。分类依据可以是①从组成方面看,HCl和HBr不含氧元素,H2SO4含氧元素;
②从物理性质方面看 。
(1)氢离子(或H+) (2)2HBr+Ca(OH)2=CaBr2+2H2O
(3)HCI、HBr有挥发性,H2SO4没有挥发性(或HCI, HBr有刺激性气味H2SO4没有)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com