
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
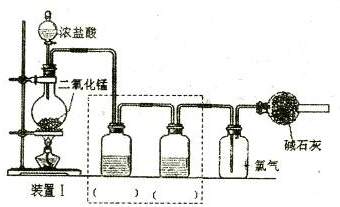
烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括
号内注明所需试剂;
14.分子甲和乙相距较远(此时它们的分子力近似为零),如果甲固定不动,乙逐渐向甲靠近越过平衡位置直到不能再靠近。在整个过程中 ( )
A.先是乙克服分子力做功,然后分子力对乙做正功。
B.先是分子力对乙做正功,然后乙克服分子力做功。
C.两分子间的斥力不断减小
D.两分子间的引力不断减小
15.用波长为 和2
和2 的光照射同一种金属,分别产生的速度最快的光电子速度之比为2:1,善朗克常数和真空中光速分别是
的光照射同一种金属,分别产生的速度最快的光电子速度之比为2:1,善朗克常数和真空中光速分别是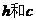 表示,那么下列说法正确的有 ( )
表示,那么下列说法正确的有 ( )
A.该种金属的逸出功为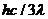
B.该种金属的逸出功为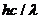
C.波长超过2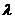 的光都不能使该金属发生光电效应
的光都不能使该金属发生光电效应
D.波长超过4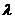 的光都不能使该金属发生光电效应
的光都不能使该金属发生光电效应
16.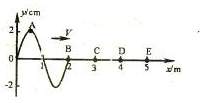 如图所示,一列简谐横波沿
如图所示,一列简谐横波沿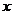 轴正方向传播,
轴正方向传播,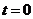 时的波形如图所示,此时被刚好传播到
时的波形如图所示,此时被刚好传播到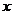 轴上的质点B,在它的左边质点A恰好位于正向最大位移处。从
轴上的质点B,在它的左边质点A恰好位于正向最大位移处。从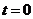 时算起,在
时算起,在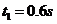 时,质点A第二次出现在负的最大位移处,则 ( )
时,质点A第二次出现在负的最大位移处,则 ( )
A.该波的传播速度为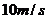
B.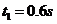 时,质点C在平衡位置处且向上运动。
时,质点C在平衡位置处且向上运动。
C.在波传播到E点以后,质点C与E都在振动时
振动情况总是相同的
D.经过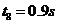 质点E第一次出现在正的最大位移处
质点E第一次出现在正的最大位移处
17.在空间某一区域中或存在匀强电场,也存在匀强磁场,有一带电粒子,以某一速度从不同方向射入到该区域中(不计带电粒子受到的重力),则该带电粒子在区域中的运动情况可能是 ( )
A.做匀速直线运动 B.做匀速圆周运动
C.做匀变速直线运动 D.做匀变速曲线运动
18.2009年7月22日,我国长江流域可以观测到罕见的日全食现象。2010年1月15日,我国再次出现更加难见的日环食现象。很多人目睹了这两次难见的奇观。若不考虑天气情况,关于日全食、日环食、日偏食,下列情况有可能出现的是 ( )
A.地球上同一地点的同一天里,日偏食和日全食都能观测到
B.地球上同一地点的同一天里,日偏食和日环食都能观测到
C.地球上同一地点的同一天里,日全食、日偏食及日环食都都能观测到
D.地球上同一地点的同一天里,只能观测到日偏食
19.已知某星球的第一宇宙速度与地球相同,其表面的重力加速度为地球表面重力加速度的一半,则该星球的平均密度与地球平均密度的比值为 ( )
A.1:2 B.1:4 C.2:1 D.4:1
20.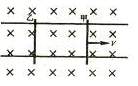 如图所示,两根光滑的平先金属导轨位于水平面内,匀强磁场与导轨所在平面垂直,两根金属杆甲和乙可在导轨上无摩擦地滑动,滑动过程中与导轨接触
良好且保持垂直。起初两根杆都静止。现突然给甲一个冲量使其获得速度V而开始运动,回路中的电阻不可忽略,那么在以后的运动中,下列说法正确的是 ( )
如图所示,两根光滑的平先金属导轨位于水平面内,匀强磁场与导轨所在平面垂直,两根金属杆甲和乙可在导轨上无摩擦地滑动,滑动过程中与导轨接触
良好且保持垂直。起初两根杆都静止。现突然给甲一个冲量使其获得速度V而开始运动,回路中的电阻不可忽略,那么在以后的运动中,下列说法正确的是 ( )
A.甲克服安培力做的功等于系统产生的焦耳热
B.甲动能的减少量等于系统产生的焦耳热
C.甲机械能的减少量等于乙获得的动能与系统
产生的焦耳热之和
D.最终两根金属杆都会停止运动
21.一物体以某一速度做平抛运动,在第1秒,第2秒,第3秒内的位移大小之比可能为( )
A.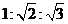 B.
B.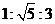 C.
C.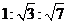 D.1:3:5
D.1:3:5
第Ⅱ卷(非选择题174分)
22. (8分)在“用单摆测量重力加速度”的实验中,某同学进行了如下测量:
(8分)在“用单摆测量重力加速度”的实验中,某同学进行了如下测量:
①用刻度尺测出摆线长为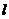 ;
;
②用游标卡尺测出摆球的直径为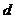 ;
;
③用天平测出摆球质量为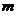 ;
;
④用秒表测出单摆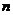 次全振动所花时间为
次全振动所花时间为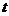 ;
;
(1)上述测量中哪一项是测量是不需要的, (填写标号)
(2)若测量摆球直径的读数情况如图,则摆球直径的测量值为 ㎜。
㎜。
(3)如果该同学根据测量的数据所算出的重力加速度的值总是偏小,可能是下列哪些原因造成的?
A.计算时将 作为摆长
作为摆长
B.计算时认为摆长就是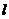
C.误将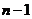 次全振动动记为
次全振动动记为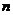 次全振动
次全振动
D.误将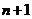 次全振动记为
次全振动记为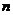 次全振动
次全振动
23.(10分)某同学利用一个改装后量程为1V的电压表和一个电阻箱测量一个干电池(内阴可忽略)的电动势E,同时还测量电压表的内阻Rr。他将上述仪表连接成如图所示的电路进行了多次测量,并根据实验数据在坐标图内描点,如图所示。
(1)该同学作图时纵坐标选用R参量,横坐标是选用1/U还是U,下列说法正确的是
( )
A.应选用1/U,才能直观、方便地求出E、Rr。
B.只是一个随意的选择,其实用U或1/U作横坐标都可以。
C.R-U图线是曲线,不能直观、方便地求出E、Rr。
D.R-U图线是曲线,可直观,方便地求出E、Rr。
(2)请在坐标图中画出合理的图线。
 (3)根据你所画出的图线求得电池的电动势为
V,电压表内阻为
kΩ。(结果保留两位有效数字)
(3)根据你所画出的图线求得电池的电动势为
V,电压表内阻为
kΩ。(结果保留两位有效数字)
24.(16分)某公共汽车的运行非常规则,先由静止开始匀加速启动,当速度达到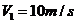 时再做匀速运动,进站前开始匀减速制动,在到达车站时刚好停住。公共汽车在每个车站停车时间均为
时再做匀速运动,进站前开始匀减速制动,在到达车站时刚好停住。公共汽车在每个车站停车时间均为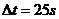 。然后以同样的方式运行至下一站。已知公共汽车在加速启动和减速
制动时加速度大小都为
。然后以同样的方式运行至下一站。已知公共汽车在加速启动和减速
制动时加速度大小都为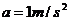 ,而所有相邻车站间的行程都为
,而所有相邻车站间的行程都为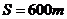 ,有一次当公共汽车刚刚抵达一个车站时,一辆电动车刚经过该车站一段时间
,有一次当公共汽车刚刚抵达一个车站时,一辆电动车刚经过该车站一段时间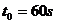 ,已知该电动车速度大小恒定为
,已知该电动车速度大小恒定为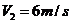 ,而且行进路线、方向与公共汽车完全相同,不考虑其他交通状况的影响,试求:
,而且行进路线、方向与公共汽车完全相同,不考虑其他交通状况的影响,试求:
(1)公共汽车从车站出发至到达下一站所需的时间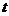 是多少?
是多少?
(2)若从下一站开始计数,公共汽车在刚到达第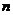 站时,电动车也恰好同时到达此车站,
站时,电动车也恰好同时到达此车站,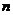 为多少?
为多少?
25.(18分)一个质量为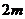 的小球被长为L的轻质细绳悬挂,小球可以绕悬点O在竖直平面内摆动,不计空气阻力,则开始小球静止且恰能与地面接触而不发生相互作用,一个质量为
的小球被长为L的轻质细绳悬挂,小球可以绕悬点O在竖直平面内摆动,不计空气阻力,则开始小球静止且恰能与地面接触而不发生相互作用,一个质量为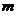 的小物块在光滑水平面上滑行并与小球发生正碰,碰后物块静止不动而小球在竖直平面内刚好可以通过最高点做圆周运动,当小球再次与物块发生正碰后,小物块速度变为最初速度的一半,已知重力加速度为
的小物块在光滑水平面上滑行并与小球发生正碰,碰后物块静止不动而小球在竖直平面内刚好可以通过最高点做圆周运动,当小球再次与物块发生正碰后,小物块速度变为最初速度的一半,已知重力加速度为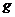 ,两物体均可视为质点,试求
,两物体均可视为质点,试求
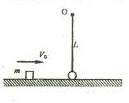 (1)小物块最初的速度V0的大小;
(1)小物块最初的速度V0的大小;
(2)第二次碰撞中系统损失的机械能 。
。
26.(20分)在某平面上有一半径为R的圆形区域,区域内外均有垂直于该平面的匀强磁场,圆外磁场范围足够大,已知两部分磁场方向相反且磁感应强度都为B,方向如图所示。现在圆形区域的边界上的A点有一个电量为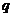 ,质量为
,质量为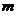 的带电粒子以沿半径且垂直于磁场方向向圆外的速度经过该圆形边界,已知该粒子只受到磁场对它的作用力。
的带电粒子以沿半径且垂直于磁场方向向圆外的速度经过该圆形边界,已知该粒子只受到磁场对它的作用力。
 (1)若粒子在其与圆心O连线旋转一周时恰好能回到A点,试救济 粒子运动速度V的可能值。
(1)若粒子在其与圆心O连线旋转一周时恰好能回到A点,试救济 粒子运动速度V的可能值。
(2)在粒子恰能回到A点的情况下,求该粒子回到A点
所需的最短时间。
27.(14分)有A、B、C、D、E、F六种主族元素,原子序数均不大于20,且原子序数依次递增。其中A与E、D与F同主族。已知A和C的核外电子数加和与E的核电荷数相同。B与C可形成两种以上的气态化合物。A与F、C与E均可形成化学式为XY2型的化合物。
(1)B元素的常见简单氢化物的空间构型是 ;C与E形成的XY2型的化合物的晶体属于 (填晶体类型),工业上从该化合物中提取E单质粗产品的方程式为 ;
(2)A与F形成的XY2型化合物的电子式为 ,该物质遇水剧烈反应反应生成一种可燃性气体,该气体的燃烧热为1306KJ/mol,请写出表示燃烧热的热化学方程式 。
(3)将D元素的单质溶于浓度很稀的B的最高价氧化物的水化物,反应中未收集到任何气体,则该反应的离子方程式为 。
28. (15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)A的结构式 ,E的化学式为 ;
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填序号)
(3)写出下列反应的化学方程式② ④
(4)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
29.(15分)化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
13.CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为 ( )
A.25% B.75% C.88% D.32%
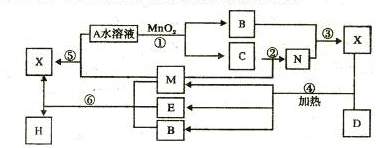
12.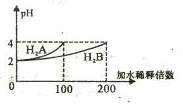 常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
11.在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)
A.配制500mL 1mol/L稀硫酸实验中,用量筒量取181mol /L浓硫酸时俯视读数
B.配制1mL 51mol/L氯化钠溶液实验中,定容时仰视
C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
10.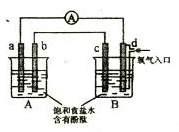 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知
化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知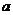 为石墨电极;
为石墨电极;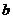 为铁电极;
为铁电极;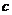 为铝电极(已除去表面氧化膜);
为铝电极(已除去表面氧化膜);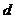 为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是 ( )
为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是 ( )
A.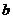 为负极,
为负极,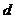 为阳极
为阳极
B.一段时间后,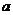 和
和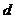 电极附近溶液变红
电极附近溶液变红
C. 电极电极反应式为:2Cl-2e-=Cl2↑
电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止
实验,再将A中溶液倒入B中混合,充分振荡,
沉淀全部消失
9.在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:
 2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是 ( )
2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是 ( )
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
8.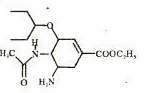 美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲原风潮。奥司他韦的结构如图;下列说法正确的是 ( )
美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲原风潮。奥司他韦的结构如图;下列说法正确的是 ( )
A.奥司他志是一种芳香族化合物,分子式为C18H28O4N3
B.1mol该化合物可以和3mol氢气发生加成反应
C.该化合物能发生水解反应,加成反应、氧化反应和消去
反应
D.奥司他韦可以和磷酸在一定条件下制取奥司他韦磷酸盐是
由于具有碱性基团氨基
7.下列离子方程式书写正确的是 ( )
A.向苯酚钠溶液中通入少量CO2;C3H2O-+CO2+H2O→C6H8OH+HCO3-
B.铝片溶于NaOH溶液:Al+2OH-=AlO2+H2↑
C.向1mol碘化亚铁的溶液中通入标准状况下22.4L氧气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
6.下列有关元素化合物的叙述中正确的是 ( )
A.碱金属原子的最外层电子数都是1,次外层电子数都是8
B.将SO2通入滴有紫色石蕊试液的水中,溶液变成红色
C.白磷易溶于水,不能保存在水中
D.高性能通信材料光 导纤维的主要原料是单品硅
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com