
4.计算模式
浓度(或物质的量) aA(g)+bB(g) 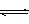 cC(g)+dD(g)
cC(g)+dD(g)
起始 m n O O
转化 ax bx cx dx
平衡 m-ax n-bx cx dx
α(A)= ×100%
×100%
ω(C)=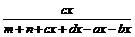 ×100%
×100%
3.在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏加德罗定律的两个推论:
(1)恒温、恒容时: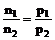 (2)恒温、恒压时:
(2)恒温、恒压时: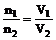
2.反应的转化率(α)
α= ×100%
×100%
1.物质浓度的变化关系
(1)反应物:平衡浓度=起始浓度一转化浓度
(2)生成物:平衡浓度=起始浓度+转化浓度
其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。
3.在恒温、恒压条件下,只要反应物(或生成物)的物质的量的比例与原平衡的相同,则两平衡属等效平衡,而且,对于非等体和等体的可逆反应均适用。
2.在恒温、恒容条件下,对于等体的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡的相同,则两平衡属等效平衡。
在一定条件下(恒温、恒容或恒温、恒压)对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同.这样的平衡称之为等效平衡。此类平衡主要有如下三种:
1.在恒温、恒容条件下,对于非等体的可逆反应,只要改变起始时加入物质的物质的量.如通过可逆反应的化学计量数之比换算成同一边物质的物质的量与原平衡相同,则两平衡属等效平衡。
6.当密闭容器的体积固定时,只改变其中一种物质的浓度时,必然同时引起压强的改变。在判断化学平衡移动的方向时,仍以浓度的影响来考虑。但在判断物质的转化率时,要同时考虑压强的影响。如:向2NO2 N2O4的平衡体系中通入N02。使c(NO2)增大,平衡向正反应方向移动;向平衡体系中通人N2O4,使c(N2O4)增大,平衡向逆反应方向移动。但由于两种情况下,容器内的压强都增大.对正反应方向的缩体反应而言,促进正向移动,对逆反应方向的扩体反应而言,抑制正向移动,故重新达到平衡时,N02的百分含量均比原平衡要小。
N2O4的平衡体系中通入N02。使c(NO2)增大,平衡向正反应方向移动;向平衡体系中通人N2O4,使c(N2O4)增大,平衡向逆反应方向移动。但由于两种情况下,容器内的压强都增大.对正反应方向的缩体反应而言,促进正向移动,对逆反应方向的扩体反应而言,抑制正向移动,故重新达到平衡时,N02的百分含量均比原平衡要小。
5.同等程度地改变反应混合物中各物质的浓度.应看作是压强的影响。如:平衡体系中各物质的浓度均增大一倍时,化学平衡向着气体分子数减少的方向移动;平衡体系中各物质的浓度均降低一半时,化学平衡向着气体分子数增大的方向移动。
4.在密闭容器中通人稀有气体,分两种情况:
(1)恒温、恒容时,通入稀有气体,压强增大,但由于原混合物各成分的浓度均没有发生变化,故化学平衡不移动。
(2)恒温、恒压时,通入稀有气体,压强不变,但由于原混合物各成分的浓度均减小,相当于减小了体系的压强,故化学平衡向着气体分子数增大的方向移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com