
21.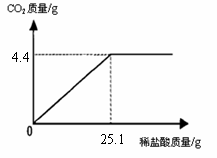 某班一次社会实践活动是到某制碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3
g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
某班一次社会实践活动是到某制碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3
g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中碳酸氢钠的质量分数。
(2)所用稀盐酸中溶质的质量分数。
解:设样品中碳酸氢钠的质量为x, 所用稀盐酸中HCl的质量为y
 NaHCO3 + HCl NaCl +
CO2↑+ H2O
NaHCO3 + HCl NaCl +
CO2↑+ H2O
84 36.5 44
x y 4.4 g
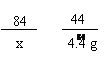
== x = 8.4 g
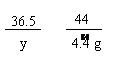
== y =3.65g
|

|
(2) 恰好完全反应时,所得溶液中溶质的质量分数为:

╳100% = 14.5%
答:略。
14.25t X
95:14.25t=74:X (1分)
X=(14.25t×74)/95=11.1t (2分)
答:理论上需要Ca(OH)2 11.1t
20.金属镁可用于火箭、飞机、轮船的制造。镁在现代材料工业中需求量逐渐增大。海水中含有约O.129%的镁元素,仅次于氯和钠,总储量约1800亿吨,开发潜力很大。
⑴在提取镁的生产过程中,需要浓缩海水,提高海水中MgCl2的质量分数,你认为既环保又经济的方法是_________________。
⑵浓缩海水中MgCl2的质量分数两9.150%,求要将150吨浓缩海水中MgCl2都转化为Mg(OH)2,理论上需要Ca(OH)2多少吨?(相对原子质量:Mg 24 Cl 35.5 Ca 40 0 16 H 1)
⑴利用太阳(光)、风等蒸发海水 (1分)
⑵解:设理论上需Ca(OH)2Xt
m(MgCl2)=150t×9.50%=14.25t
MgCl2+Ca(OH)2=Mg(OH)2 ↓+ CaCl2 (1分)
95 74
19.以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
|
试管编号 |
加入液体 |
加入物质 |
现象 |
|
1 |
10 mL水 |
少量食盐 |
不溶 |
|
2 |
10 mL乙醇 |
少量食盐 |
溶解 |
|
3 |
10 mL水 |
几小粒碘 |
不溶 |
|
4 |
10 mL乙醇 |
几小粒碘 |
溶解 |
(1)在同一条件下,物质的溶解能力与 和 有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件 有关。
如果外界条件和溶剂的种类确定,要比较硝酸钾和氯化钠的溶解能力,实验中需要控制的因素是 。
(3)根据甲、乙两种固体物质的溶解度曲线,你能获得的信息是 (答两条)。
(1)溶质的性质 溶剂的性质 (2)温度 溶剂的量(或)溶质的量
(3)①甲物质的溶解度受温度变化的影响比乙大;②15℃时,甲、乙两物质的溶解度相等(或温度低于15℃时,乙物质的溶解度大于甲物质的溶解度;温度高于15℃时,乙物质的溶解度小于甲物质的溶解度);③甲、乙两物质的溶解度均随温度的升高而增大;④30℃时,甲物质的溶解度是30 g 。
18.烟台是一座美丽的濒海城市,海水是一种重要的自然资源,烟台市对海水资源进行了充分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行可得到粗盐,粗盐不能直接用于工业生产和人们的日常生活。为了充分应用必须对粗盐进行提纯,则粗盐的提纯步骤为 、 、
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
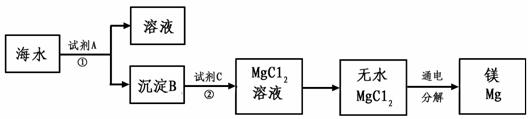 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为
,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为
,
由无水MgCl2制取Mg的化学方程式为 。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。

①、步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 。
②、制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
③、该制碱方法称为侯氏制碱法,其制碱法的优点有四:A.生产过程中部分产品可作为原始材料使用;B.副产品是一种可利用的的化肥;C.反应不需要加热,可节约能源;D.副产品不会造成污染。你认为其中正确的是___ __
(1)蒸馏法(或多级闪急蒸馏法或) (2)溶解、过滤、蒸发
(3) Mg(OH)2 MgCl2 通电 Mg+Cl2↑ 海水中含有氯化钠等多种溶质,氯化镁的浓度很低
(4) ①、NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△ Na2CO3+ H2O+CO2↑
②、氨气溶于水形成碱性溶液,更易于吸收二氧化碳
③、ABD
17.填空回答除去氯化锌固体中少量氯化铜杂质实验中的相关问题:
⑴.将固体置于烧杯中,加适量蒸馏水并用玻璃棒搅拌,搅拌的作用是_____________
 ⑵.向溶液中加人过量的__________并搅拌,此方法和我国古代“湿法冶铜”的原理一样,可用化学方程式表示为__________
⑵.向溶液中加人过量的__________并搅拌,此方法和我国古代“湿法冶铜”的原理一样,可用化学方程式表示为__________
⑶.将混合液过滤,滤纸上留下的固体是___________;
⑷.指出右图过滤操作中的两处错误:①___________;②___________。
(1)加快溶解 (2)锌粉 Zn+CuCl2=ZnCl2+Cu (3)铜和锌
(4)①未用玻璃棒引流 ②漏斗下端未紧靠烧杯内壁
16.右图是甲、乙两种物质在水中的溶解度曲线。

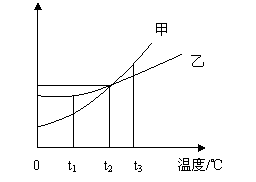 (1)在________℃时,可配制溶质质量分数相等的
(1)在________℃时,可配制溶质质量分数相等的
甲、乙两种物质的饱和溶液。
(2)我国西北部有许多盐碱湖,湖水中有大量的
NaCl、Na2CO3,那里的人们冬天捞碱,夏天晒盐。
据此,你认为图中(填“甲”或“乙”)__________
的溶解度曲线与纯碱的溶解度曲线相似,其理由是_________
(1)t2 (2) 甲 纯碱的溶解度随温度变化较大
15.从HCl、NaCl、NaOH、Na2CO3、Ca(OH)2几种溶液中取出其中的两种混合,可能的组合共有_________种。
(1)若混合后溶液质量减小,可能的组合是:______、_________。
(2)若混合后溶液质量不变,但发生了化学反应,有关的化学方程式为:
_________________、____________。
(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生气体与加入
稀硫酸有如图所示的关系,则这样的组合可能是____。
 10;(1)HCl、Na2CO3;Na2CO3、Ca(OH)2;
10;(1)HCl、Na2CO3;Na2CO3、Ca(OH)2;
(2)HCl+NaOH==NaCl+H2O;2HCl+Ca(OH)2==CaCl2+2H2O;
(3)NaOH、Na2CO3;Ca(OH)2、Na2CO3
14.干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠、水和二氧化碳,该反应的化学方程式为 。油锅中的油不慎着火,可用锅盖盖灭,其灭火原理是 。家中煤气若泄漏,应及时采取的措施是 。
2NaHCO3△Na2CO3 + H2O + CO2↑ 隔绝氧气或隔绝空气 关闭煤气阀门(或开关),打开门窗通风换气等
13. 下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。请回答:
下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。请回答:
(1)选择氧气、铁、二氧化碳、氧化钙、稀硫酸、烧碱溶液、氯化钡溶液、碳酸钙中的五种物质(所选物质至少属于“单质、氧化物、酸、碱、盐”中的四种类别),将其化学式分别填入对应的环内。
(2)“五连环”中物质间发生的反应,没有涉及的基本反应类型是 。
(1)(说明:五种物质的化学式全部正确得分。)
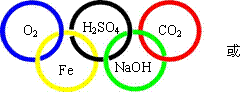
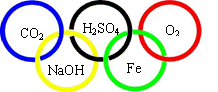
(2)分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com