
1.构成原子的各粒子间的关系,有时结合阿伏伽德罗常数,氧化还原反应来进行考察。如“氯气发生氧化还原反应时,1摩尔氯气一定得到2摩尔电子”,很多学生没有考虑到氯气还可能发生自身氧化还原反应,还如铜与硫反应时生成的是硫化亚铜而不是硫化铜,要求考生在平时的练习中要注意总结。
5. 原子结构知识的综合推断
要求综合运用电子排布的规律,判断元素种类。
核外电子排布规律(1)核外电子是由里向外,分层排布的。
(2)各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
[例5] 周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A________、B________、C________(填元素符号)。
[解析] 本题采用平均值法解答比较简单。由A、B、C三元素为相邻元素以及它们的平均质子数41/3≈14<18,可知A、B、C三元素为短周期元素;又根据最外层电子数的平均值19/3≈6.3<7,推知其中必有最外层电子数为7的元素,所以A、B、C三种元素应分布在ⅥA、ⅦA族,经推断A为S,B为Cl、C为O符合题意。
4. 微粒大小比较
要求熟练掌握微粒大小比较规律。
考查微粒半径大小比较规律
(1)同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2)同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
(3)电子层结构相同的离子,核电荷数越大,则离子半径越小。
(4)同种元素的微粒半径:阳离子<原子<阴离子。
(5)稀有气体元素的原子半径大于同周期元素原子半径。
(6)电子层数多的阴离子半径一定大于电子层数少的阳离子半径,但电子层数多的阳离子半径不一定大于电子层数少的阴离子半径。
[例4] X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X
[解析] 对于电子层结构相同的离子,核电荷数越大,半径越小,现X元素的阳离子半径大于Y,故核电荷数应是Y>X。Z和Y的电子层数相同,则它们在同一周期,随着核电荷数的递增,原子半径逐渐减小,现Z的原子半径小于Y,则核电荷数Z>Y。综合以上关系得Z>Y>X。本题正确答案为D。
3. 有关同位素的计算
要求熟练掌握同位素的定义,同位素相对原子质量和元素相对原子质量之间的关系。
考查对同位素的理解掌握
同位素(1)同--质子数相同,异--中子数不同,微粒--原子。
(2)同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。
[例3] 铜有两种天然同位素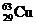 和
和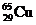 ,参考铜的原子量(63.5)估算
,参考铜的原子量(63.5)估算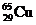 的百分含量约是
的百分含量约是
A.20% B.25% C.50% D.66.7% E.75%
[解析] 用十字交叉法可求得两种同位素的原子个数比

即 与
与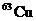 的原子个数比为1∶3,所以
的原子个数比为1∶3,所以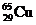 %=
%=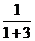 ×100%=25%,故应选B
×100%=25%,故应选B
2. 根据元素周期律知识推断元素及化合物的性质
要求熟练掌握位、构、性三者关系,结构决定位置,结构决定性质,位置体现性质。考查位、构、性三者联系。
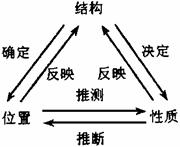
[例2] 砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是
A.HAt很稳定 B.易溶于某些有机溶剂
C.AgAt不溶于水 D.是有色固体
[解析] 由题意,砹在周期表中与碘相邻,故它的性质与碘具有相似性,但它的非金属性应比碘弱。HAt的稳定不如HI,故选项A错误;碘易溶于某些有机溶剂,则砹也应溶解;AgI不溶于水,则AgAt也不溶于水;碘是紫黑色固体,根据相似性砹也是有色固体。
1. 关于质量数、质子数、中子数和核电荷数的推断
要求熟悉有关的基本概念,要注意区分一些易混淆的概念,如相对原子质量与质量数,元素的相对原子质量与原子的相对原子质量,核素与同位素等。
考查几个量的关系(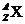 ) 质量数(A)=质子数(Z)+中子数(N)
) 质量数(A)=质子数(Z)+中子数(N)
质子数=核电荷数=原子序数=原子的核外电子数
离子电荷数=质子数-核外电子数
以及相对原子质量(1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。它是相对质量,单位为1,可忽略不写。(2)元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。元素周期表中的相对原子质量就是指元素的相对原子质量。
[例1] 设某元素某原子核内的质子数为m,中子数为n,则下述论断中正确的是
A.不能由此确定该元素的相对原子质量
B.这种原子的相对原子质量为m+n
C.若碳原子质量为wg,此原子的质量为(m+n)wg
D.核内中子的总质量小于质子的质量
[解析] 元素的相对原子质量和原子的相对原子质量是两个不同的概念,要求元素的相对原子质量,必须知道其各种同位素的相对原子质量和原子个数百分数,否则无法求解,故选项A正确。质子数m+中子数n应为质量数,不是相对原子质量,选项B错误。由相对原子质量的数学表达式可知,某原子的质量=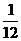 ×一种碳原子质量×该原子的相对原子质量,故选项C错误。1个质子的质量略小于1个中子的质量,但核内质子的总质量与中子的总质量还要取决于质子和中子数目的多少,选项D错误。
×一种碳原子质量×该原子的相对原子质量,故选项C错误。1个质子的质量略小于1个中子的质量,但核内质子的总质量与中子的总质量还要取决于质子和中子数目的多少,选项D错误。
考题常以重大科技成果为题材,考查考生接受新知识和分析问题的能力。
原子结构考察的内容有同位素中各种粒子数目的等量关系及简单的数学运算;原子离子半径的大小比较。
元素周期律考查表现在知识的迁移应用,根据“位,构,性”关系推断元素性质。有关化学键和分子极性的考察,主要有判断化学键类型,分子极性;用分子间作用力,氢键解释有关分子晶体的问题,用分子极性解释溶解性的问题。
对晶体的类型与性质的考察有晶体结构的确定,晶体性质的比较。以氯化钠,氯化铯,干冰,二氧化硅,金刚石的结构为载体进行其他物质结构的分析。
理解原子结构及同位素的概念,理解原子序数,核电荷数,质子数,中子数,核外电子数,以及质量数与质子数,中子数之间的相互关系,了解第1.2.3周期的元素原子核外电子的排布规律。
理解离子键,共价键的含义,理解极性键和非极性键。了解极性分子和非极性分子,分子间作用力。初步了解氢键。了解几种晶体类型(原子晶体,离子晶体,分子晶体,金属晶体)及其性质。
掌握元素周期律的实质,了解元素周期表(长式)的结构(周期,族)及其应用。
掌握同一周期内元素(如原子半径,化合价,单质及化合物性质)的递变规律与原子结构的关系;掌握同一主族内元素性质的递变规律与原子结构的关系。
5.树立信心、锻炼意志 信心、意志是提高复习效果、复习效率、复习成绩的重要前提。学生要把信心意志的培养和锻炼贯穿于一轮复习的全过程。不要认为考试成绩不理想,就不自信怀疑自己,认为自己基础知识不牢固,审题能力差,应变能力弱,甚至从根本上否定自己,失掉了学习化学的信心,失去了大好未来,高考更是考能力考心理素质,多少平时成绩突出的学生心理素质不过硬在高考考场上失利,要想在高考考场上有上好的成绩,好的心理素质是必不可少的。
4.重视考试,重视讲评 每回考试和练习,都是一次提高的过程。讲评试卷的过程,是教师根据学生试卷上反映出来的信息,将知识清晰化、脉络化的过程。教师要通过错题分析,总结规律,举一反三,触类旁通;根据出现错误的性质,找出发生错误的原因,避免下次再犯。归纳试题的解题思路和方法,最佳解法,以便提高学生的解题速度和正确率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com