
28.[有机化学基础] Ⅰ.莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示。
Ⅰ.莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示。
(1)该有机物的分子式为:_____________________
(2)1 mola最多消耗_____________molNaOH
Ⅱ.下图中X是一种具有果香味的合成香料,D蒸气的密度是相同条件下氢气密度的14倍,E是生活中常见的一种有机物。

回答下列问题:
(3)A分子中官能团的名称 。
(4)B→C的化学反应类型为 反应。
(5)A的一种同分异构体F不能发生消去反应,则F的结构简式为 。
C+ E→X的化学方程式为 。
福建省三明市市区三校2010届高三联考试卷
28.[物质结构与性质](8分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
 试回答下列问题:
(1)请写出元素o的基态原子电子排布式
。
(2)d的氢化物中心原子的杂化方式是
。
(3)c、e、k三种元素的电负性数值由小到大的顺序为
(用元素符号作答)。
(4)f、l、q的氢化物中沸点最高的是
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
。
(2)d的氢化物中心原子的杂化方式是
。
(3)c、e、k三种元素的电负性数值由小到大的顺序为
(用元素符号作答)。
(4)f、l、q的氢化物中沸点最高的是  (写化学式)
(5)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点 jc晶体的熔点(填“大于”“等于”“小于”)原因是:
(写化学式)
(5)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点 jc晶体的熔点(填“大于”“等于”“小于”)原因是:
27.(11分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
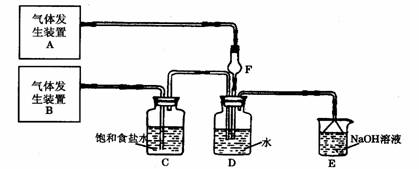
(1)气体发生装置A产生的气体是 ;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I 若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,实验现象是: ;
II 若SO2过量:取适量D中溶液滴加至盛有
(选填一个序号)试剂的试管内,实验现象是:

(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
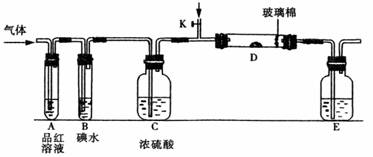
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
[来源:]
26.(10分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量。
(1)氨被氧化生成一氧化氮的化学方程式为: 。
(2)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用氮气表示的反应速率为: 。
(3)在(2)中反应达到平衡后,再充入1mol N2、2mol H2 、3mol NH3,保持温度不变,此时平衡向__________反应方向移动(填“正”或“逆”)。
(4)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在
常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高
质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶
薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)
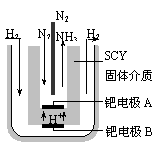
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
25.(8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
24.(7分)铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是______________________________________。
(2)硫酸铁可作絮凝剂,常用于净水,其原理是_______________________________(用离子方程式表示)。
(3)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4 + 4 CO  3 Fe + 4 CO2
,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3 Fe + 4 CO2
,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
|
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
I对;II对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
I错;II对;无 |
|
D |
在空气中铁表面形成致密氧化膜 |
铁不能与氧气反应 |
I对;II对;有 |
23.(7分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
② 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
________________________________________________________________________
22.(7分)化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为
。
(2)0.1 mol/L X的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为
(3)Y的单质在放电条件下能与氧气反应。写出化学方程式:
__________________________________________________________________
(4)化合物A能与水缓慢反应生成含Y的化合物Z,Z分子中含有10个电子。写出该
反应的化学方程式:

21.某无色溶液中只可能含有①Na+ 、②Ba2+、 ③Cl-、 ④Br-、⑤SO32-、⑥SO42- 离子中的若干种(忽略水电离出的H+、OH),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
20. 稀土金属元素铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A. 在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
B. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑
CeI4 + 2H2↑
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ == Ce3+ + 2Fe3+
D. 四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同系物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com