
3.(2007年海南)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( ) [答案]D。
(A)②④⑤③① (B)③②④①⑤ (C)③④②⑤① (D)②④③⑤①
2.(2007年广东)为了避免青铜器生成铜绿,以下方法正确的是( ) [答案]BD。
(A)将青铜器放在银质托盘上 (B)将青铜器保存在干燥的环境中
(C)将青铜器保存在潮湿的空气中 (D)在青铜器的表面覆盖一层防渗的高分子膜
1.(2007年广东)许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( ) [答案]D
(A)氯、溴、碘 (B)钠、镁、铝 (C)烧碱、氢气 (D)食盐、淡水
2、金属活动性与电极放电规律总结:
[课后巩固]
例2:黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO 、SiO2、Al2O3)可制备Fe2O3。方法为① 用稀盐酸浸取炉渣,过滤。
② 滤液先氧化,再加人过量某试剂过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.检验和除去滤液中Al3+的试剂为 除去的离子方程式是 。
b.选用提供的试剂设计实验验证炉渣中含有Fe2O3。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
所选试剂为 。操作步骤为
证明炉渣中含有FeO 的实验现象为 。
例3、(09全国) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是

 A. 1:4 B.1:5 C. 2:3 D.2:5
A. 1:4 B.1:5 C. 2:3 D.2:5
 答案A
答案A
例4、(2007年北京)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________;
化合反应____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与钦锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)______________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
[答案](1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu;
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。
(2)白色沉淀生成,后沉淀逐渐溶解至消失。 Al3++3OH- = Al(OH)3↓,
Al(OH)3+OH- = AlO2- +2H2O。(3)①3MnO2+4Al 3Mn+2Al2O3。
3Mn+2Al2O3。
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。
[知识规律小结]
1、铝的两性及实验现象描述分析:
2、Cu2+ 、 Mg2+ 、Fe2+ 、Fe3+的分离:
1、Fe2+、Fe3+ 的检验方法:
2.需重点掌握的反应:
氧化铜:与强酸反应的离子方程式______________________________
与氢气反应的化学方程式_____________________________
与CO反应的化学方程式_____________________________
氢氧化铜:与强酸的反应的离子方程式______________________________
与乙醛反应的化学方程式_____________________________
硫酸铜:与少量的氨水反应_____________________________
与过量的氨水反应_____________________________
(考查分析:近两年的考查热点是铜的还原性特别是铜与硝酸的反应考查较多,对铜的考查往往与铁紧密相关,以考查氧化还原知识为主,主要以实验题型考查,建议加强关注在电化学和有机化学中与铜有关的问题。)
[课堂讨论]一、金属化合物的性质及检验
例1:(09山东30)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:


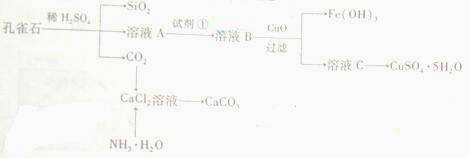

 请回答下列问题:
请回答下列问题:
 (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
 a.KMnO4 b.(NH4)
2S
c.H2O2
d.KSCN
a.KMnO4 b.(NH4)
2S
c.H2O2
d.KSCN
 (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
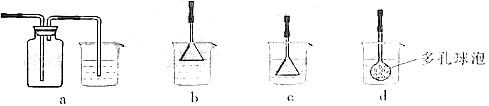
 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。



 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。

 [答案](1)c d (2)冷却结晶 引流 (3)NH3 (或NH3·H2O) b d (4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平 酸式
[答案](1)c d (2)冷却结晶 引流 (3)NH3 (或NH3·H2O) b d (4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平 酸式
 [解析](1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN- (2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
[解析](1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN- (2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
 [考点分析]考查化学实验的基本操作、物质的提纯与鉴别、实验室安全等
[考点分析]考查化学实验的基本操作、物质的提纯与鉴别、实验室安全等
[知识规律小结]
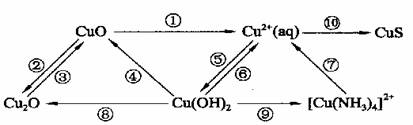
1.知识体系
 ·
·
2.需重点掌握的反应:铁与非氧化性强酸反应: 铁与三价铁盐反应:
铁与铜盐反应: 铁在氧气中燃烧:
铁与高温水蒸气反应: 氢氧化亚铁露置与空气中:
三价铁与铜反应: 三价铁离子的检验:
二价铁离子的检验:
(考查分析:近两年的考查热点是从氧化还原角度考查铁单质、二价铁、三价铁的性质及转化关系,以及铁的氧化物和氢氧化物的性质及制备,考查题型主要有离子共存、离子方程式、实验(除杂、制备)等,对铁的考查仍将是以上热点,除此之外加强关注二价铁、三价铁的检验及离子共存问题、钢铁的腐蚀问题)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com