
5、(07山东)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。在腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
解答:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2-4.7;③过滤[除去Fe(OH)3]。
[课堂讨论]
4、用离子方程式和必要的文字解释下列现象或原理
明矾净水原理
配制FeCl3溶液加几滴盐酸溶液
判断AlCl3溶液加热蒸干灼烧得到产物
3、泡沫灭火器内含浓的NaHCO3溶液(置于铁桶内)和浓的Al2(SO4) 3 溶液(置于玻璃瓶内),使用时把灭火器倒置即有泡沫状物质喷出灭火。
①写出灭火器倒置时反应的离子方程式
②有人建议:把浓Al2(SO4)3溶液置于铁桶内,而把固体NaHCO3置于玻璃瓶内中,此建议 (填“妥当”或“不妥当”),其原因是 。
2、(2008山东)下列说法正确的是
A.SiH4比CH4稳定B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱[答案]C
9、(2008年宁夏)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
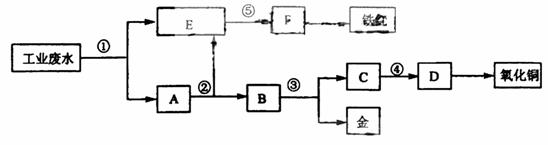
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;
写出③处发生反应的化学方程式
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜
[答案](1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
第二课时 金属元素及化合物性质应用
[课前预习]
.1、(2007年江苏)向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是( )
(A)K+、Br-、CO32 - (B)Al3+、H+、MnO4-
(C)NH4+、Fe3+、SO42 - (D)Ag+、Cu2+、NO3- [答案]A。
8.(2008海南)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO; ②3Mg+N2
2MgO; ②3Mg+N2 Mg3N2; ③2Mg+CO2
Mg3N2; ③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2
+6H2O
MgO+H2↑ ⑤Mg3N2
+6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
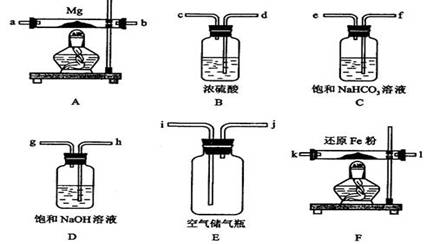
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_____________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:________________________
[答案](1)B、D、F 选择B,目的:除去空气中的水蒸气
选择D,目的:除去空气中的CO2 选择F,目的:除去空气中的O2
(2)h→g→d→c→k→l→a→b
(3)制得的氮化镁将不纯;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应生成其它物质。
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物有氮化镁
7.(2007年海南) 下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是______和_______;
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:_________________________________________,__________________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_____________________________________________________
_______________________________________________。
[答案](1)Si;Ar。 (2)K;F。 (3)Al;2Al(OH)3+3H2SO4 = Al2(SO4)3+6H2O;Al(OH)3+KOH = KAlO2+2H2O。
(4)在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强
6.(2007年上海)用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( ) [答案]D。
(A)实验中发生的反应都是氧化还原反应
(B)铝是一种较活泼的金属
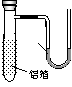

(C)铝与氧气反应放出大量的热量 (D)铝片上生成的白毛是氧化铝和氧化汞的混合物
5.(2008重庆)下列叙述正确的是
A. 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C. Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D. NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体[答案]C
4. (2007年高考广东理基)下列说法正确的是( )
(A)所有不锈钢都只含有金属元素(B)我国流通的硬币材质是金属单质
(C)广东正在打捞的明代沉船上存在大量铝制餐具(D)镁合金的硬度和强度均高于纯镁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com