
3.(2007年高考广东理基)下列反应的离子方程式正确的是( )
(A)向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH- = 2H2O+BaCl2
(B)往FeCl3溶液中加入Fe粉:2Fe3++Fe = 3Fe2+
(C)往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2 = CaCO3↓+H2O
(D)往FeCl3溶液中加入Cu粉:Fe3++Cu = Fe2++Cu2+
[答案]B。
2.(2007年高考广东化学卷)下列化学反应的离子方程式正确的是( )
(A)用小苏打治疗胃酸过多:HCO3- +H+=CO2↑+H2O
(B)往碳酸镁中滴加稀盐酸:CO32 -+2H+=CO2↑+H2O
(C)往氨水中滴加氯化铝溶液:Al3++4OH-=AlO2- +2H2O
(D)氢氧化钡溶液与稀硫酸反应:Ba2++SO42 -+H++OH-=BaSO4↓+H2O
[答案]A。
1.(2008江苏)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物:
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝的存在形式:
D.氨水与SO2反应后溶液中的铵盐:
[答案]B
例1.(09北京) 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 I 从废液中提纯并结晶处FeSO4·7H2O。
I 从废液中提纯并结晶处FeSO4·7H2O。
 II将
II将 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
 IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
固体
 V煅烧
V煅烧 ,得到
,得到 固体
固体
 已知:
已知: 在热水中分解
在热水中分解
(1)
 I中,加足量的铁屑出去废液中的
I中,加足量的铁屑出去废液中的 ,该反应的离子方程式是
,该反应的离子方程式是
(2)
 II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3)
 III中,生成
III中,生成 的离子方程式是
。若
的离子方程式是
。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(4)
 IV中,通过检验
IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是
。
操作是是
。
(5)
 已知煅烧
已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧
,现煅烧
464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g· ;
; )
)
 答案.
答案.  (1)Fe + 2Fe3+
= 3Fe2+
(1)Fe + 2Fe3+
= 3Fe2+

 (2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O
(2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O Fe(OH)2
+ 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2
+ 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解

 (3)Fe2+ + 2HCO3-
= FeCO3↓+ CO2 ↑ + H2O
(3)Fe2+ + 2HCO3-
= FeCO3↓+ CO2 ↑ + H2O

 4FeCO3
+ 6H2O + O2 = 4Fe(OH)3 ↓+ 4CO2
4FeCO3
+ 6H2O + O2 = 4Fe(OH)3 ↓+ 4CO2

 (4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净

 (5)288.0
(5)288.0
[规律总结]物质性质与制备方法:
[变式3](2008年山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4
d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
[答案]⑴Cu、O;⑵b、c;⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
(离子方程式不配平不扣分)⑷a:2Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];
b:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
[课后巩固]
例1.(09天津)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

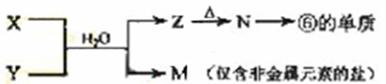
 X溶液与Y溶液反应的离子方程式为_____________________,
X溶液与Y溶液反应的离子方程式为_____________________,
 N→⑥的单质的化学方程式为________________。
N→⑥的单质的化学方程式为________________。
 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。

例2、(2008上海)(A)四种短周期元素的性质或结构信息如下表。根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的电子排布式
⑵写出C单质与水反应的化学方程式
A与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
⑶D元素最高价氧化物晶体的硬度 (填“大于”、“小”),其理由是
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实
(B)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是 ,写出D离子的电子排布式 。
⑵D和C形成的化合物属于 晶体。
写出C单质与水反应的化学方程式 。
⑶对元素B的单质或化合物描述正确的是 。
a. B元素的最高正价为+6
b. 常温、常压下单质难溶于水
c. 单质分子中含有18个电子
d. 在一定条件下镁条能与单质B反应
⑷A和D量元素金属性较强的是(写元素符号) 。写出能证明该结论的一个实验事实
[答案](A)⑴第三周期 ⅦA 1s22s22p63s23p4 ⑵2Na+2H2O=2NaOH+H2↑ 大于
⑶大 SiO2是原子晶体 或 小 CO2是分子晶体
⑷Cl 高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
(B) ⑴Mg 1s22s22p6 ⑵离子 2F2+2H2O=4HF+O2⑶b d(B是氧气或氮气)
⑷Na 钠与水反应比镁与反应剧烈后氢扬化钠的碱性比氢氧化镁强
[规律总结]元素周期律与金属性:
[变式2]
1.(2007年上海)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
X |
L层p电子数比s电子数多2个 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。写出元素Z的气态氢化物的电子式__________(用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式_____________________________________
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
[答案](1) ;
;  。
(2)H++AlO2- +H2O
。
(2)H++AlO2- +H2O Al(OH)3
Al(OH)3 Al3++3OH
Al3++3OH
(3)F; c。 (4)Al; 具有金属性。
3、(2007年高考理综宁夏卷)下列反应的离子方程式正确的是( )
(A)锌片插入硝酸银溶液中:Zn+Ag+ = Zn2++Ag
(B)碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH = Ca2++2CH3COO-+2CO2↑+2H2O
(C)少量金属钠加到冷水中:Na+2H2O = Na++OH-+H2↑
(D)氢氧化铜加到盐酸中:Cu(OH)2+2H+ = Cu2++2H2O[答案]D。
2、 (09福建)从铝土矿(主要成分是
(09福建)从铝土矿(主要成分是 ,含
,含 、
、 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:

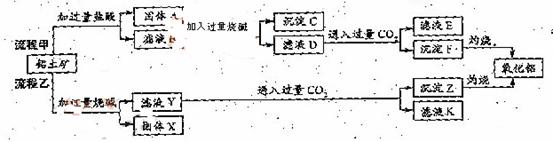
 请回答下列问题:
请回答下列问题:
 (1)流程甲加入盐酸后生成Al3+的方程式为_________.
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
 (2)流程乙加入烧碱后生成Si
(2)流程乙加入烧碱后生成Si 的离子方程式为________.
的离子方程式为________.
 (3)验证滤液B含
(3)验证滤液B含 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
 (5)已知298K时,
(5)已知298K时, 的容度积常数
的容度积常数 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的 =_______.
=_______.
 [答案]
[答案] (1)Al2O3 + 6H+
(1)Al2O3 + 6H+  2Al3+ +3H2O
2Al3+ +3H2O  (2)SiO2
+ 2OH-
(2)SiO2
+ 2OH-  SiO32 - + H2O
SiO32 - + H2O
 (3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
 (4)NaHCO3;制纯碱或做发酵粉等合理答案
(4)NaHCO3;制纯碱或做发酵粉等合理答案  (5)5.6×10-10mol/L
(5)5.6×10-10mol/L
1.
 (09全国)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
(09全国)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有 ,
, 阴离子有
阴离子有 ,现将它们分别配成
,现将它们分别配成 的溶液,进行如下实验:
的溶液,进行如下实验:
① 
 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 
 向D溶液中滴加
向D溶液中滴加 溶液,无明显现象;
溶液,无明显现象;
④ 
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。

 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1) 
 实验②中反应的化学方程式是
实验②中反应的化学方程式是

 ;
;

 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是

 ;
;

 (3)写出下列四种化合物的化学式:A
、C
、
(3)写出下列四种化合物的化学式:A
、C
、

 D
、F
.
D
、F
.

 答案
答案


2、离子方程式书写:
[变式1]
例1. (09全国)下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+、NO3-、NH4+、Cl- B.Ca2+、HCO3-、NH4+、AlO2-
C.K+、Ba2+、Cl-、HSO3- D.Mg2+、NH4+、SO42-、K+ 答案.D
例2. (09)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
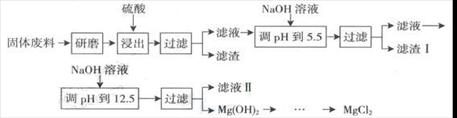
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.4 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)
(2)滤渣I的主要成分有 。 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
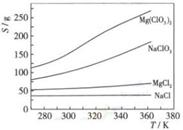 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
解答(1)增大硫酸浓度;加热升高温度;边加硫酸边搅拌(要求写出两条)
(2)滤渣Ⅰ主要成分有Fe(OH)3、Al(OH)3
(3)从滤液Ⅱ中可回收利用的主要物质有CaSO4、Na2SO4
(4)①该反应的生成物为Mg(ClO3)2和NaCl的混合溶液,NaCl的溶解度随温度变化不大,Mg(ClO3)2的溶解度随温度升高而升高。利用两物的溶解度差异,通过加热蒸发浓缩,冷却结晶,过滤,将Mg(ClO3)2与NaCl分离,制得Mg(ClO3)2。
②因为在相同温度向下NaCl的溶解度最小,所以在冷却结晶过程中,会有少量NaCl随Mg(ClO3)2析出;重结晶
[规律总结]
1、由Ksp求算沉淀pH:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com