
12.在体积可变的密闭容器中,反应mA(气)+nB(固) pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
A.(m+n)必定小于p B.(m+n)必定大于p C.m必定小于p D.n必定大于p
11.(2007北京卷)一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)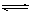 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S) B.将容器体积变为20L,Z的平衡浓度变为原来1/2
C.若增大压强,则物质Y的转化率减小 D.若升高温度,X的体积分数增大,则该反应的△H>0
10.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s) △H>0 下列叙述正确的是
Z(g)+W(s) △H>0 下列叙述正确的是
A 加入少量W,逆反应速率增大 B 当容器中气体压强不变时,反应达到平衡
C 升高温度,平衡逆向移动 D 平衡后加入X,上述反应的△H增大
9. (2005全国)已知反应A2(g)+2B2(g) 2AB2(g)的△H<0,下列说法正确的是 ( )
(2005全国)已知反应A2(g)+2B2(g) 2AB2(g)的△H<0,下列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
8.(08宁夏卷)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
考点5.外界条件对化学平衡的影响
7.(09年宁夏理综·13)在一定温度下,反应H2(g)+X2(g) HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
6.(08山东卷)高温下,某反应达平衡,平衡常数K= .恒容时,温度升高,H2浓度减小。下列说法正确的是( )
.恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO+H2O=CO2+H2
5.(2005年北京春)一定条件下,在密闭容器中,能表示反应X(气)+2 Y(气)产 2 Z(气),一定达到化学平衡状态的是①X、Y、Z的物质的量之比为l:2:2
②X、Y、Z的浓度不再发生变化; ③容器中的压强不再发生变化; ④单位时间内生成n mol Z,同时生成2n mol Y
2 Z(气),一定达到化学平衡状态的是①X、Y、Z的物质的量之比为l:2:2
②X、Y、Z的浓度不再发生变化; ③容器中的压强不再发生变化; ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
考点4.化学平衡常数的应用及注意事项
4.(广东化学20)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;(Ⅱ)实验①和 探究温度对该反应速率的影响;(Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
 (2)实验①中CO2质量随时间变化的关系见下图:
(2)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式: CaCO3+HNO3=
CaCO3+HNO3= Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+ H2O,
H2O,
计算实验①在70-90 s范围内HNO3的平均反应
速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和
④中CO2质量随时间变化关系的预期结果示意图。
考点3.化学平衡状态的标志
3.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )

A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com