
3、 具有相同电子层结构的微粒,
2、 同一主族的原子半径: (从上到下)
同一主族的离子半径: (从上到下)
1、 同一周期的原子半径: (从左到右)
5.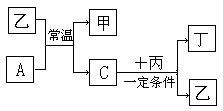 A、B、C、D为四种气体单质,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙。C和D化合生成化合物丁。已知甲、乙、丙每个分子含有的电子数均为10,乙常温下为液态。并且有如下转化关系,填空:
A、B、C、D为四种气体单质,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙。C和D化合生成化合物丁。已知甲、乙、丙每个分子含有的电子数均为10,乙常温下为液态。并且有如下转化关系,填空:
(1)单质B的化学式 单质D的结构式
(2)单质A和化合物乙反应的化学方程式
(3)单质C和化合物丙反应的化学方程式
(4)根据你说学习的知识推断:丙和丁能否反应,若反应写出相应的化学方程式,若不能反应直接写“不能”两字。
知识点8 微粒半径的比较
4.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)、A、B、C元素符号分别为: 。
(2)、D是由两种元素组成的双原子分子,其分子式是___________。
(3)、E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是___________。
(4)、F是由两种元素组成的三原子分子,其结构式是____________。
(5)、H分子中含有8个原子,常温下,燃烧H的气体1g放出的热量为52KJ/mol,则相应的热化学方程式为:
(6)、G分子中含有4个原子,该物质加入MnO2可以产生一种能支持燃烧的气体:
①G的溶液中加入少量二氧化锰,有无色气体生成,写出化学方程式
②G的溶液中加入足量氯化亚铁和稀硫酸,溶液的颜色变成棕黄色,该反应的离子方程式为:
,根据你现有的化学知识,上述反应能否设计成原电池,若能画出相应的装置图,若不能,说出原因或理由:
3. a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1)a微粒结构示意图
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示),b和e离子的氧化性较强的为: 。
(3)d溶于水的电离方程式
(4)g微粒的电子式
(5)c微粒是 , f微粒是 (用化学式表示)
(6)写出f离子的电子式:
2、(09北京)甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-l价的元素
2、18电子微粒
单核:Ar、K+、Ca2+、Cl―、S2―、P3- 双核:F2、HCl、HS― 三核:H2S 四核:PH3、H2O2
五核:SiH4、CH3F 六核:N2H4、CH3OH 七核:N2H5+ 八核:C2H6、N2H62+
[注]14电子微粒 2电子微粒:
[典型例题]例7、(07全国II)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是_______、B元素是_______、C元素是_______(用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是___________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是___________。
(4)F是由两种元素组成的三原子分子,其分子式是___________,电子式是____________。
(5)G分子中含有4个原子,其分子式是_____________。
(6)H分子中含有8个原子,其分子式是_____________。
[答案](1)K、Cl、S。 (2)HCl。 (3)F2。 (4)H2S, 。(5)H2O2(答PH3同样给分)。 (6)C2H6。
。(5)H2O2(答PH3同样给分)。 (6)C2H6。
[点击高考]1、(07江苏)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A________;B_________;C_________;D_________。
(2)写出A、B、E三种微粒反应的离子方程式:_______________________________。
[答案](1)H2O;NH3;NH4+ ;OH-。(2) Mg2++2NH3+2H2O = Mg(OH)2↓+2NH4+ [或Al3++3NH3+3H2O = Al(OH)3↓+3NH4+ ]。
1、10电子微粒:
不带电:Ne、HF、H2O、NH3、CH4 带正电:Na+、Mg2+、Al3+、NH4+、H3O+ 带负电:F―、O2―、N3-、OH―、NH2-
5、几种常见的表达方式
(1) 原子结构示意图
(2) 电子式
(3) 核外电子排布式
(4) 核外电子排布简式
(5) 外围电子(价电子)表达式
(6) 轨道示意图
[典型例题]例6、(07海南)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
答案:(1)N(2)Cl K(3)Fe 1s22s22p63s23p63d64s2(4) Cu 1s22s22p63s23p63d104s1
考点:本题考查了常见元素种类推断以及原子结构。解析:(1)A元素原子核外共有5个电子,则核内为5个质子,因此为N。(2)B、C分别为17、19号元素即Cl、K。(3)D3+的电子排布式为1s22s22p63s23p63d5,可知D为26号元素,即Fe,因此其基态原子的电子排布式为1s22s22p63s23p63d64s2。(4)E元素原子核外共有29个电子,即第29号元素为Cu,电子排布式为1s22s22p63s23p63d104s1。
[点击高考]1.(09宁夏)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
答案:(1)1s22s22p63s23p63d104s24p3 As(2) (3)三角锥
(3)三角锥
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O (5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。
解析:(1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;(2)Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H.(3)-(5)就不再分析了。[点评]涉及电子排布的问题,一般相对简单,这也是目前选修科目的一个趋势。
知识点7、10电子微粒和18电子微粒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com