
(二)盐类水解的条件:盐必须能 ;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等。
(一) 盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟 结合生成 ,从而了水的电离。
1、等体积、等浓度的一元酸和一元碱溶液混合,两者恰好完全中和,有以下三种情况
⑴.强酸与强碱溶液混合,所得溶液为 性
⑵.强酸与弱碱溶液混合,所得溶液为 性,原因是
⑶.弱酸与强碱溶液混合,所得溶液为 性,原因是
归纳: 、
2、等体积的酸和碱溶液混合,且酸溶液中的pH与碱溶液中的pH之和为14。
⑴.强酸与强碱溶液混合,所得溶液为 性
⑵.强酸与弱碱溶液混合,所得溶液为 性,原因是
⑶.弱酸与强碱溶液混合,所得溶液为 性,原因是
归纳: 、 、
例7:下列混合溶液中,各离子浓度的大小顺序正确的是( )
A 10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合: c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合: c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后:B. c(M+)>c(A-)>c(H+)>c(OH-)
例8: (08年上海)某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
例9:常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-)
强化训练:
1.(08年全国理综I·12)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1 的 NaA 和 NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+) C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
2、常温下,将V1mLc1mol•L-1的氨水滴加到V2mLc2mol•L-1的盐酸中,下列结论正确的是
A.若V1= V2,且溶液的pH<7,则一定有c1< c2 B.若c1= c2,且V1= V2,则混合液中c(NH4+)= c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)> c(Cl-) D.若混合液的pH=7,则混合液中c1V1> c2V2
3(09西城)常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中水电离出的c(H+)=1×10-10 mol·L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol·L-1
C.该溶液与0.05 mol·L-1 NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
4.现有等体积的Ba(OH)2、NaOH和NH3•H2O三种溶液,将它们分别与V1L、V2L、V3L等浓度的盐酸混合,下列说法中正确的是
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大
5某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A=H++HA- HA- 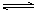 H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。理由是____________(用离子方程式表示)
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B.c(OH-)=c(H+) +c( HA-)
a+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) a+ )= 2c(A2-) +2c( HA-)
(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是_______0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是: ____________________________________________________________
(4)0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______________________________________________
6、有甲、乙两份等体积的浓度均为0.1mol/L的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡将向________(填“促进”或“抑制”)电离的方向移动,溶液的pH将为________(填序号). A.9-10之间 B.11 C.12-13之间 D.13
(2)乙用0.1mol/L的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是______________________________________.
7、已知氨水的电离程度与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固) 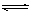 Mg2++2OH-……① NH4++H2O
Mg2++2OH-……① NH4++H2O 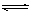 NH3·H2O+H+……② H++OH-═ H2O……③ ,
NH3·H2O+H+……② H++OH-═ H2O……③ ,
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固) 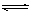 Mg2++2OH-……① NH4++OH-═ NH3·H2O……②由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
Mg2++2OH-……① NH4++OH-═ NH3·H2O……②由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由____________ ;
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
第二讲 水的电离和pH计算
考纲分析:
1、了解水的电离和水的离子积常数。
2、掌握影响水电离平衡的因素
典型例题:
例1:某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为 ;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为 。
例2:填表
|
实例 |
H2O OH-+H+ OH-+H+ |
||||
|
条件改变 |
平衡移 动方向 |
电离程度变化 |
溶液中离子总浓度变化 |
H2O电离出C(H+)变化 |
Kw变化 |
|
升高温度 |
|
|
|
|
|
|
加HCl |
|
|
|
|
|
|
加NaOH |
|
|
|
|
|
|
加CH3COONa |
|
|
|
|
|
|
加NH4Cl |
|
|
|
|
|
|
加入NaCl固体 |
|
|
|
|
|
例3:分析下列问题:
(1) 常温下,物质的量浓度为0.001mol/L的盐酸溶液,求水电离出的氢离子浓度。
(2) 常温下、物质的量浓度为0.005mol/L的氢氧化钡溶液,求水电离出的氢氧根离子浓度。
例4:分析回答下列问题:
(1)物质的量浓度相同的盐酸和硫酸,水电离出的氢离子浓度大的是: 。
(2)物质的量浓度相同的盐酸和醋酸,水电离出的氢离子浓度大的是: 。
(3)常温下,pH相同的盐酸和醋酸溶液,水电离出的氢子浓度: 。
(4)常温下,pH=3的盐酸和pH=11的氢氧化钠溶液,水电离出的氢离子浓度: 。
(5)常温下,pH=4的氯化铵和pH=10的醋酸钠溶液,水的电离的电离程度: 。
例5:常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离度由大到小顺序排列的是( )
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3
A.①>②>③>④ B.①>④>③>② C.②>①>③>④ D.②>③>④>①
例6:回答下列问题:
(1) 由水电离出的氢离子浓度为1×10-10mol/L的溶液,该溶液的pH可能为?
(2)由水电离出的氢氧根离子浓度为1×10-10mol/L的溶液,该溶液的pH可能为?
强化训练:
1(07北京)7.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
2、下列说法中正确的是( )
①任何物质的水溶液中,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度。
②在酸(本身是酸)溶液中,溶液的氢氧根离子可以代表水的电离程度。
③在碱(本身是碱)溶液中,溶液的氢离子可以代表水的电离程度。
④在NH4Cl溶液中,溶液中的氢离子可以代表水的电离程度。
A、①③ B、③④ C、①②③④ D、①④
3、A、B、C、D、E为短周期主族元素,原子序数依此增加,已知B是地壳中含量最高的元素,D原子最外层电子数是最内层电子数的3倍,D、E同周期,A、C同主族,A的原子半径在所有元素中原子半径中最小。X、Y、Z均为由上述五中元素中的三种组成的强电解质,组成元素的原子数之均为:1:1:1。相同温度下,物质的量浓度相同的三种溶液中,X水的电离程度比Y、Z溶液水的电离程度都小,Y是一种常用的消毒液的有效成分。
(1)写出X溶液和Z溶液混合的离子方程式:
(2)若某浓度的Y溶液常温时pH=12,则水电离出的氢氧根离子浓度为: 。
写出体现水电离出的氢离子和氢氧根离子浓度相等的式子: 。
(3)简要说明X溶液中水的电离程度比Y溶液水的电离程度小大的原因:
(4)分析用惰性电极电解CE溶液,在阴极附近为什么会显碱性: 。
4、(09届海淀期中)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
PH值计算典型例题:
例1:用0.1mol/L NaOH溶液滴定0.1mol/L盐酸,如达到滴定终点时不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL),继续加水至50mL,所得溶液的pH为( )
A.4 B.7.2 C.10 D.11.3
例2:(08年全国理综Ⅱ·9)取浓度相同的NaOH 和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为C
A.0.01mol·L-1 B.0.017mol·L-1 C.005mol·L-1 D.0.50mol·L-1
例3:(2002全国9)有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg(c( H+]/c( OH-])。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1 B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG>0 D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
例4:某温度(t℃)时,水的Kw=10-13,则该温度(填大于、小于或等于)____25℃,其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b 。 (2)若所得混合液的pH=2,则a︰b 。
强化训练:
1、 (07年高考全国理综卷I·7)室温时,下列混合溶液的pH一定小于7的是( )
A.pH = 3的盐酸和pH = 11的氨水等体积混合
B.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的醋酸和pH = 11的氢氧化钡溶液等体积混合
D.pH = 3的硫酸和pH = 11的氨水等体积混合
2、pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
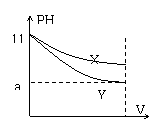 A、X、Y两种碱的物质的量浓度一定相等
A、X、Y两种碱的物质的量浓度一定相等
B、稀释后,X溶液碱性比Y溶液碱性强
C、若9<a<11,则X、Y都是弱碱
D、完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
3、用惰性电极电解饱和的食盐水100ml,经过一段时间后,阴极收集到112mlH2(标准状况),此时电解液的pH为(电解液的体积保持不变) ( )
A、13 B、12 C、8 D、1
4、(06高考天津理综10)下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
5、.室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
C.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足: C(B+)>C(A-)>C(H+)>C(OH-)
6、(07年高考海南化学卷·3)下列叙述正确的是( )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 B.pH = 3的醋酸溶液,稀释至10倍后pH = 4
C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 1 D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH = 7
7.25℃时,有pH=a的盐酸和pH=b的NaOH溶液,取VaL盐酸溶液与NaOH中和,需VbLNaOH溶液,问:(1)若a + b =14, 则  = (填数字)
= (填数字)
(2)若a + b =13, 则  =
(填数字)
=
(填数字)
(3)若a + b >14, 则  =
(填表达式),且Va Vb(填“>”“<”或“=”)
=
(填表达式),且Va Vb(填“>”“<”或“=”)
(4)若a + b =15, 则  =
(填数字)
=
(填数字)
8.氢氧化镁难溶于水,但它所溶解的那一部分认为在溶液中完全电离。常温时,饱和氢氧化镁溶液的pH=11,则该温度下氢氧化镁的溶解度是多少?(溶液的密度为1 g/mL)
9(1)常温时,将pH=8的某NaOH溶液与pH=4的某H2SO4溶液混合,得到pH=7的混合溶液。求NaOH溶液与硫酸的体积比。
(2)已知90°C时,水的离子积常数为1×10-12。在此温度下,将pH=8的NaOH溶液与pH=4的H2SO4溶液混合,也得到pH=7的混合溶液。求NaOH溶液与硫酸体积比。
(假设稀溶液混合体积具有加和性)
第三讲 盐类的水解
[课标要求]
1、理解盐类水解的概念和盐类水解反应的本质原因,能熟练地写出盐类水解反应的化学方程式和离子方程式。
2、了解其它水解反应类型,掌握盐类水解的应用。
3、掌握对离子共存问题的分析与判断。
[知识梳理]
一。 盐类水解反应的本质:
2、pH相同、体积相同的盐酸与醋酸的对比
|
|
c(H+) |
c(酸) |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后 的pH变化情况 |
||
|
产生氢 气的量 |
开始时的 反应速率 |
反应过程中速率 变化情况 |
|||||
|
盐酸 |
|
|
|
|
|
|
|
|
醋酸 |
|
|
|
|
|
|
|
[例6]一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是___________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为____________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率______,反应所需的时间____。
⑥将c(H+)相同的三种酸均稀释10倍,c(H+)由大到小的顺序为__________________。
[练习](2007上海化学)下列关于盐酸与醋酸两种稀溶液的说法正确的是
A 相同浓度的两溶液中c(H+)相同 B 100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C pH=3的两溶液稀释100倍,pH都为5 D 两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
1、物质的量浓度相同、体积相同的盐酸与醋酸的对比
|
|
c(H+) |
pH |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后 的pH变化情况 |
||
|
产生氢 气的量 |
开始时的 反应速率 |
反应过程中速率变化情况 |
|||||
|
盐酸 |
|
|
|
|
|
|
|
|
醋酸 |
|
|
|
|
|
|
|
3.影响电离平衡的因素:
(1)决定性因素:
(2)外因:
[实例分析]
[例3](09年海南·6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
 A.该溶液的pH=4
A.该溶液的pH=4 B.升高温度,溶液的pH增大
B.升高温度,溶液的pH增大
 C.此酸的电离平衡常数约为1×10-7
C.此酸的电离平衡常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
[例4](08天津卷)醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
[例5](2007上海化学)已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH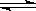 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A 加少量烧碱溶液 B 升高温度 C 加少量冰醋酸 D 加水
[练习]1. 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是:
A.在冰醋酸中这四种酸都没有完全电离 B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42- D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
2:关于0.1mol·L-1CH3COOH溶液,下列说法中正确的是 ( )
① 加水稀释时,溶液中所有离子浓度都减小。
② 加入少量0.1 mol·L-1HCl溶液,溶液中c(H+) 减小。
③ 加入少量CH3COONa固体,因为醋酸钠水解显碱性,所以平衡向正反应方向移动。
④ 加入少量CH3COONa固体,因为醋酸钠会电离出很多的醋酸根离子,所以平衡向逆反应方向移动。
⑤ 若加入少量的冰醋酸,则氢离子浓度减小
⑥ 若加入少量的冰醋酸,醋酸溶液的电离程度减小。
A、④⑥ B、①② C、 ①②③④⑥ D、都正确
3: 25℃时,在浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的溶液中,测得其中c(NH4+)分别为a、b、c(mol·L-1),则下列判断正确的是( )
A. a>b>c B. c>a>b C. b>a>c D. a >c>b
2.特点:
[思考与交流]①氢硫酸溶液存在如下平衡:H2S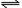 H++HS-,HS-
H++HS-,HS- H++S2-。现使该溶液中pH值增大,则c(S2-)如何变化?
H++S2-。现使该溶液中pH值增大,则c(S2-)如何变化?
②请用电离平衡移动原理解释为何Al (OH)3既能溶于强酸,又能溶于强碱?
1.电离平衡概念:______________________________________________________
5、 同一周期的不同离子半径的比较(以第三周期为例)
教学反思
原子结构是元素性质的根本,原子结构是分子组成和结构的基础,所以本部分内容是物质结构的基础。因而要引导学生深入理解原子结构与元素性质的关系。
高考化学对原子结构、同位素的考查,经常以重大科技成果知识为背景,寓教于考,充分突出基础知识与科学研究的统一。
4、 同一元素的不同微粒的半径比较:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com