
(1)制作化学电源
(2)判断金属活动性强弱
(3)加快某些化学反应速率
(4)揭示钢铁腐蚀的原因,预防金属防腐小节:(金属腐蚀的快慢规律)
注:金属的腐蚀与防护
1.金属的腐蚀
(1)定义
(2)实质
(1) 类型:化学腐蚀和电化学腐蚀
①化学腐蚀:
②电化学腐蚀(以钢铁为例)
列表比较化学腐蚀和电化学腐蚀
|
|
化学腐蚀 |
电化学腐蚀 |
|
|
定义 |
|
|
|
|
|
|
||
|
条件 |
金属与非电解质直接接触 |
|
|
|
本质 |
金属被氧化而腐蚀 |
|
|
|
现象 |
无电流产生 |
|
|
|
反应式 |
|
负极: |
|
|
正极: |
正极: |
||
|
联系 |
|
6.PH值变化:
5.电极反应式和总反应式的书写:
例: 已知下列原电池的总反应式,请写出其电极反应式,并归纳如何根据原电池的总反应式正确书写电极反应式。
① Zn+CuSO4=ZnSO4+Cu
② 2Zn+4NH4Cl+4MnO2=[Zn(NH3)4]Cl2+ZnCl2+2Mn2O3+2H2O
③ CH4+2O2+2KOH=K2CO3+3H2O
4.原电池正负极的判断方法:
原电池有两个电极,一个是正极,一个是负极。判断正极和负极的方法是:
3.构成条件:
2.基本组成:
1.工作原理:
(1)电荷守恒:
(2)物料守恒:
(3)质子守恒:
思考与交流5:请分析醋酸钠溶液中存在的微粒和离子浓度的大小顺序?
[例8]写出下列物质的水溶液中的电荷守恒与物料守恒的表达式:
NH4Cl:电荷守恒____________________________物料守恒__________________________
Na2CO3:电荷守恒____________________________物料守恒__________________________
NaH2PO4:电荷守恒____________________________物料守恒__________________________
(NH4)2S:电荷守恒____________________________物料守恒__________________________
(四)特征
(1)水解 :盐+水 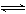 酸 + 碱,ΔH 0
酸 + 碱,ΔH 0
(2)盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大。
[特别提醒]:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素。
填写下列表格:水解反应:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
|
条件 |
平衡移动方向 |
Fe3+浓度 |
Fe3+的水解程度 |
PH |
|
|
浓度 |
加FeCl3 |
|
|
|
|
|
加水 |
|
|
|
|
|
|
温度升高 |
|
|
|
|
|
|
加HCl |
|
|
|
|
|
|
加少量的NaOH |
|
|
|
|
|
|
加Na2CO3 |
|
|
|
|
二。 盐类水解的应用
1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为: NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>(NH4)2SO4>NaHSO4
2.比较盐溶液中各离子浓度的相对大小时,当盐中含有 的离子,需考虑盐的水解。
3.判断溶液中离子能否大量共存。当有 和 之间能发出双水解反应时, 在溶液中大量共存。
如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存。
4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来 盐的水解。
5.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取(会完全水解),只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入 气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体。
6.化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈 。
7.某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在 的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 。
8.溶液中,某些离子的除杂,需考虑盐的水解。
9.用盐溶液来代替酸碱
10.明矾能够用来净水的原理
[特别提醒]:盐类水解的应用都是从水解的本质出发的。会解三类习题:(1)比较大小型,例:比较PH值大小;比较离子数目大小等。(2)实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等。(3)反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等。
[实例分析]
[例1] 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( ) ①KNO3 ②NaOH ③CH3COO NH4 ④NH4Cl A、①>②>③>④ B、④>③>①>② C、③>④>②>① D、③>④>①>②
[例2] 在0.1 mol·L-1的 NH4Cl和0.1 mol·L-1的氨水混合溶液中,各离子浓度的大小顺序。
[例3]蒸干FeCl3水溶液后再强热,得到的固体物质主要是 ( )
A. FeCl3 B. FeCl3·6H2O C. Fe(OH)3 D. Fe2O3
[例4](09年天津理综·4)下列叙述正确的是
 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
[例5]物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH分别为7、8、9,则同物质的量浓度的这三种一元酸的酸性由强到弱的顺序是
A.HX、HY、HZ B.HZ、HY、HX C.HX、HZ、HY D.HY、HX、HZ
[例6](09年福建)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-下列说法正确的是
HCO3-+OH-下列说法正确的是
 A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
 C.升高温度,
C.升高温度, 减小 D.加入NaOH固体,溶液pH减小
减小 D.加入NaOH固体,溶液pH减小
[例7](09年上海化学·17)根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
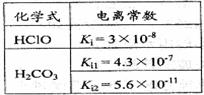
 A.c(HCO3-)>c(ClO-)>c(OH-)
A.c(HCO3-)>c(ClO-)>c(OH-)
 B.c(ClO-)>c(HCO3-)>c(H+)
B.c(ClO-)>c(HCO3-)>c(H+)
 C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
 D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
(三)盐类水解的结果
(1) 了水的电离。
(2)盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 。(3)生成了弱电解质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com