
7.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯
中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是
6LiCl+Li2SO3+2S,下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
6.有关下图装置中的叙述正确的是

A.这是电解NaOH溶液的装置 B.溶液中发生了变化:4Fe(OH)2+O2+2H2O 4Fe(OH)3
4Fe(OH)3
C.Fe为负极,电极反应为:Fe-2e-+2OH- Fe(OH)2 D.NaOH溶液的碱性逐渐减弱
Fe(OH)2 D.NaOH溶液的碱性逐渐减弱
5. (2009·东城模拟)摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH-  2CO32-+6H2O,则下列说法不正确的是
2CO32-+6H2O,则下列说法不正确的是
A.充电时,电能转化为化学能
B.充电时,电解质溶液的pH逐渐增大
C.放电时,CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为:CH3OH+8OH--6e- CO32-+6H2O
CO32-+6H2O
4.如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是
|
|
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸溶液 |
|
B |
铜 |
铁 |
稀盐酸 |
|
C |
银 |
锌 |
硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁溶液 |
3.下列关于钢铁腐蚀的叙述正确的是
A.吸氧腐蚀时正极放出氧气 B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率 D.析氢腐蚀比吸氧腐蚀普遍
2.理论上不能设计成原电池的化学反应是
A.HNO3(l)+NaOH(l) NaNO3(l)+H2O(l);ΔH<0
NaNO3(l)+H2O(l);ΔH<0
B.CH4(g)+2O2(g)
 CO2(g)+2H2O(l);ΔH<0
CO2(g)+2H2O(l);ΔH<0
 C.2H2(g)+O2(g)
C.2H2(g)+O2(g)
 2H2O(l);ΔH<0
2H2O(l);ΔH<0
D.2FeCl3(l)+Fe(s) 3FeCl2(l);ΔH<0
3FeCl2(l);ΔH<0
2. 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应 ;负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
|
Fe3+ |
1.9 |
3.2 |
|
|
Fe2+ |
7.0 |
9.0 |
|
|
Cu2+ |
4.7 |
6.7 |
|
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
|||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 ; 。劣质不锈钢腐蚀的实验现象 。
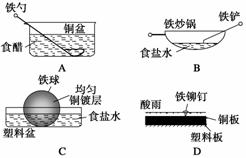
[课后练习]1.相同材料的铁在图中的四种情况下最不易被腐蚀的是
例3.将a g锌粒与足量稀硫酸反应,产生气体的量随时间的变化曲线如下图实线所示,在相同条件下,a g含杂质的锌粒(杂质与酸不反应)与同浓度的稀硫酸反应,则相应的曲线如图中的虚线所示。正确的是

[练习]实验室制备氢气最好的方法 。
题型四 书写电极反应式、总反应式
例4.一种新型燃料电池,一极通入空气,另一极通入丁烷气体:电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO3)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2--由负极移向正极
B.电池的总反应是:2C4H10+13O2 → 8CO2+10H2O
C.通入空气的一极是正级,电极反应为:O2+4e- 2O2--
D.通入丁烷的一极是正极,电极反应为:C4H10+26e--+13O2-- 4CO2+SH2O
[练习](2007年高考海南化学卷)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。


请回答下列问题: (1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的____极,发生的电极反应为__________; X电极上发生的电极反应为_______________。 (3)外电路中的电子是从_______电极流向________电极。
题型五 分析电极反应
例4.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO
 2PbSO4+2H2O
2PbSO4+2H2O
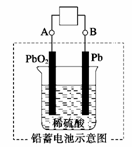
则下列说法正确的是
A.放电时:负极板上发生了还原反应 B.放电时:正极反应是Pb-2e-+SO
 PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
[练习](2005江苏高考,14)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-====Zn(OH)2 B.充电时阳极反应为:Fe(OH)2-3e-+5OH-==== FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 D.放电时正极附近溶液的碱性增强
题型六 综合应用
例6(2008·北京理综,5)据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e- 4OH-
4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2 2H2O
2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
例7有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源,它依靠人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作,试分析其工作原理,并写出有关反应的化学方程式。
[练习](2008·重庆理综,12)如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是

A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
题型七 有关原电池的实验设计
 实验设计
实验设计
试用铁棒、铜棒、浓硝酸、导线为材料设计原电池,写出电极反应方程式和总反应方程式。
答案 负极(Cu):Cu-2e- Cu2+ 正极(Fe):2NO
Cu2+ 正极(Fe):2NO +4H++2e-
+4H++2e- 2NO2↑+2H2O
2NO2↑+2H2O
总反应方程式:Cu+4H++2NO
 Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O
 实验拓展
实验拓展
1.已知反应AsO +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O是可逆反应,现设计下图所示装置进行下述操作:①向B烧杯中逐滴加入浓HCl,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表中指针向①中所述相反方向偏转。
+I2+H2O是可逆反应,现设计下图所示装置进行下述操作:①向B烧杯中逐滴加入浓HCl,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表中指针向①中所述相反方向偏转。

试回答下列问题:
(1)两次操作过程中指针为什么会发生偏转,并且指针偏转方向相反。
答:
。
(2)操作①过程中C1为 极,电极反应式为 。
(3)操作②过程中C2为 极,电极反应式为 。
例1.下列关于原电池的叙述,正确的是 ( )
A.构成原电池的正极和负极必须是两种活泼性不同的金属
B.电子从负极流向正极,电流从正极流向负极
C.在电解质溶液中,阴离子从负极向正极移动,阳离子从正极向负极移动
D.原电池工作时,正极发生还原反应,负极发生氧化反应
[练习]将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列各叙述正确的是
A 负极有Cl2逸出,正极有H2逸出 B 负极附近Cl-的浓度减小
C 正极附近Cl-的浓度逐渐增大 D 溶液中Cl-的浓度基本不变
题型二。确定金属活动性顺序
例2.有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A A>B>C>D B D>A>B>C C C>A>B>D D B>C>A>D
[练习]1.由A、B、C、D四种金属按下表中装置进行实验。
|
装置 |
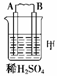 |
 |
 |
|
现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 。
(2)装置乙中正极的电极反应式是 。
(3)装置丙中溶液的pH (填“变大”、“变小”或“不变”)。(4)四种金属活泼性由强到弱的顺序是 。
2.有关X、Y、Z、W四种金属进行如下实验:
|
① |
将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
|
② |
将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
|
③ |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强 B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出 D.用X、Z和稀硫酸可构成原电池,且X做负极
2.金属的防护
(1)金属防护的基本思路:防止金属与化学物质直接接触,防止形成原电池。
(2)防护方法:
①改变金属内部结构:
②覆盖保护层:
③电化学保护法:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com