
8.用惰性电极电解500mL含KNO3和Cu(N03)2的混合液,一段时间后,在两极上均生成11.2L(标准状况)气体。则原溶液中Cu2+的物质的量浓度为 。
7. 在密闭容器中进行A2(g)+4B2(g)
在密闭容器中进行A2(g)+4B2(g) 2C2(g)+3D2(g)的反应,其中A2、B2、C2、D2的起始浓度分别是0.1mol/L、0.4mol/L、0.2mol/L、0.3mol/L,当反应达到平衡时,各物质的浓度不可能是( )
2C2(g)+3D2(g)的反应,其中A2、B2、C2、D2的起始浓度分别是0.1mol/L、0.4mol/L、0.2mol/L、0.3mol/L,当反应达到平衡时,各物质的浓度不可能是( )
A.c(A2)=0.15mol/L B.c(B2)=0.9 mol/L C. c(C2)=0.3mol/L D.c(D2)=0.6 mol/L
6.A.B可能分别属于饱和一元醇、醛、羧酸或酯类中的任两种,取1 molA,B混合物与2.5molO2恰好反应产生2molC02和2.5 molH2O,则关于A,B成分的判断正确的是( )
A.一定含醇 B.肯定有醛 C.可能有醛 D.无法确定
5.若以ω1和ω2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A.2ω1=ω2 B.2ω2=ω1 C.ω2>2ω1 D.ω1<ω2<2ω1
4.下列说法中正确的是( )
A.标准状况下,22.4L水中含有NA个水分子
B.1mol甲基(-CH3)中含有9NA个电子
C.5.6g Fe与足量C12反应时,失去电子数为O.2NA
D.1LO.5mol/L BaCl2溶液中,Ba2+与Cl-总数为1.5 NA
3.含FeS2A %的黄铁矿W吨,在用接触法制硫酸的过程中,损失硫C%,可制得浓度为B%的硫酸为( )
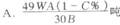
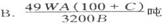
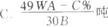
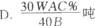
2.在相同状况下,下列两个反应放出的热量分别用Q1、Q2表示:H2(g)+1/202(g)=H20(g),△H=-Q1 ;2H2( g)+O2(g)=2H20(L),△H=-Q2,则Ql与Q2的关系为( )
A. Ql>Q2 B. Ql=Q2 C. 2Q1<Q2 D. Q1=2Q2
1.用惰性电极电解某金属硫酸盐溶液时,在阴极上析出m g金属,同时在阳极上析出O.8g气体,如果该金属的相对原子质量为M,则其化合价为( )

10.400 K、101 KPa时,1.5 L某烃蒸气能在a LO2中完全燃烧,体积增大至(a+3)L(相同状况)
(1)该烃分子组成上必须满足的条件是 。
(2)当a=10L时,烃可能的分子式为 。
(3)某烃为C7H8时,a的取值范围是 。
9.在一定温度下,把mg相对分子质量为M的可溶性盐溶解在VmL水中(水的密度为1 g/cm3),恰好形成饱和溶液(溶液密度为rg/cm3),则该溶液中溶质的质量分数是 ,溶质的物质的量浓度是 ,该温度下此盐的溶解度是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com