
13.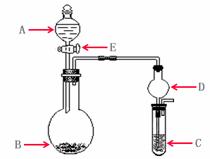
 (12分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
(12分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
 (1)若A中为
(1)若A中为 的H
的H 溶液,B中固体为
溶液,B中固体为 ,C中盛有
,C中盛有 和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
 (2)若A中浓盐酸,B中装有固体
(2)若A中浓盐酸,B中装有固体 ,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM
,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM 发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
 (3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。 仪器D在此实验中的作用是___________________。
仪器D在此实验中的作用是___________________。
14(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合 利用率高,废弃物少。
利用率高,废弃物少。
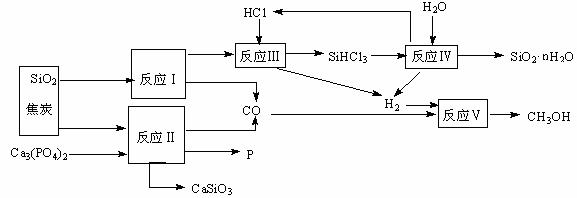
(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
12.下列离子方程式书写不正确的是
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:
4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3+ + 3CH3COOH + 11H2O
第Ⅱ卷(非选择题 共78分)
11. 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如 下图所示,有关洋蓟素的说法正确的是
下图所示,有关洋蓟素的说法正确的是
A.分子中含有4个手性碳原子
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与11molNaOH反应
10.下列化学实验事实解释正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是 因为铜可直接与1mol/L稀硫酸反应
因为铜可直接与1mol/L稀硫酸反应
B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
C.相同物质的量浓度乙酸铅溶液导电能力比乙酸钙弱得多,说明乙酸铅属于非电解质
D.浓NH4Cl溶液处理过的舞台幕布不易着火,是因为处理后幕布质量增加,着火点升高
9.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
 D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
8、某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的一项是
 A.有机物A 最多20个原子共平面
B.有机物A 可以和Br2的CCl4溶液发生加成反应
A.有机物A 最多20个原子共平面
B.有机物A 可以和Br2的CCl4溶液发生加成反应
C.有机物A 和浓硫酸混合加热,可以发生消去反应
D.1 mo1A 和足量的NaOH 溶液反应,最多可以消耗2mol NaOH
7、下列实验方案可行的是( )
A.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
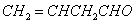 B.证明
中一定有碳碳不饱和键:滴入KMnO4酸性溶液,看紫红色是否褪去
B.证明
中一定有碳碳不饱和键:滴入KMnO4酸性溶液,看紫红色是否褪去
C.检验溶液中一定有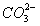 :加入稀盐酸,将产生的气体通入澄清石灰水
:加入稀盐酸,将产生的气体通入澄清石灰水
D.用溴水鉴别苯、乙醇、四氯化碳.
6、NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.标况下,11.2L氯仿中的C-Cl键数目为1.5NA
B.1 mol冰中,氢键的数目是NA
C.28克乙烯和聚乙烯的混合物完全燃烧生成CO2分子数为2 NA
D.将5.6克铁投入一定量的硝酸中,转移电子数为0.3NA
3.下列说法正确的是
A.两难溶电解质作比较时,Ksp小的,溶解度一定小;
B. Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净;
D. 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,此溶液为AgCl的饱和溶液
4.下列涉及有机物的性质或应用的说法不正确的是
A.干馏煤可以得到甲烷、苯和氨等重要化工原料
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.用大米酿的酒在一定条件下密封保存,时间越长越香醇
D.油脂都不能使溴的四氯化碳溶液褪色
5.元素X.Y.Z原子序数之和为36,X.Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最强
D.同周期元素中Y的最高价含氧酸的酸性最强
2.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是 A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.以上均不是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com