
16.(4分) ⑴填表:下列物质用途主要利用物理性质的,填写其对应的物理性质;主要利用化学性质的,填写其对应的化学反应方程式。
|
序号 |
物质 |
用途 |
物理性质或化学反应方程式 |
|
① |
铝 |
制铝箔及电缆线 |
|
|
② |
纯碱 |
制取苛性钠 |
|
|
③ |
酒精 |
内燃机的燃料 |
|
⑵下图是汽车尾气处理过程中发生的某个反应的微观示意图。

图中一种小球代表一种元素的原子,三种原子分别是C、N、O。该反应的化学方程式为_______________________________________ _。
15. 某一溶液由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液中的一种,或由其中几种混合形成,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示。则下列判断正确的是
某一溶液由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液中的一种,或由其中几种混合形成,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示。则下列判断正确的是
A. 该溶液中不可能含有碳酸钠
B. 该溶液含有硫酸或盐酸,也可能两种同时含有
C. 该溶液中是否含有氯化铜不能确定
D. 从上述信息可知该溶液的组成只可能有一种情况
14.下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
A.CaCl2(CaCO3) 加足量稀硫酸、蒸发、结晶
B.NaCl(Na2CO3) 加足量稀盐酸、蒸发、结晶
C.Fe(Cu) 加足量稀盐酸、过滤、洗涤、干燥
D.MnO2(KCl) 加足量水溶解、过滤、洗涤、干燥
13.有A、B两种混合粉末,质量分别为m1,m2。A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成。将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg。下列说法正确的是(已知:KHCO3 + HCl == KCl + CO2↑+ H2O ,NaHCO3 + HCl == NaCl + CO2↑+ H2O)
A. 21m1 = 25m2
B.m1 = m2
C.混合物B中MgCO3和NaHCO3质量比可为任意比
D.混合物A中CaCO3和KHCO3质量比一定为1∶1
12. 推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊溶液变红。通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
C.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
D.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
11.汽车用铅蓄电池中需要质量分数为28%的稀硫酸。若在实验室中用10g 质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制28%的稀硫酸,下列做法或说法正确的是(水的密度近似看作1g/cm3)
A.将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌
B.将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌
C.若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28%
D.配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和
10. 如图,实验桌上放置的两容器中盛有等体积的醋酸和水两种液体。几天后,两者的体积都明显减少,且醋酸比水减少得多。由此现象得出的正确结论是
 A.
醋酸与水都能挥发
A.
醋酸与水都能挥发
B. 醋酸比水易挥发
C. 醋酸的熔点比水高
D. 醋酸的沸点比水高
9.以下各装置能完成相应实验的是
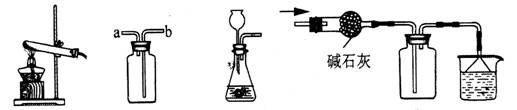
① ② ③ ④
A.装置③:制取氧气、氢气等气体 B.装置④:干燥,收集HCl气体
C.装置①:用氯酸钾制氧气 D.装置②:由b进气收集O2或CO2气体
8.一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示下列叙述正确的是
|
物质 |
A |
B |
C |
D |
|
第一次测得的质量/g |
50 |
4 |
4.6 |
1 |
|
第二次测得的质量/g |
待测 |
20 |
23 |
4.2 |
A.上述反应属于化合反应 B.该反应应C与D的质量变化之比为23:4
C.第二次测得A的质量为12.4g D.该反应中共生成D的质量为4.2g
7.下列实验设计方案中,可行的是
A. 用足量稀盐酸除去混在铜粉中的少量镁粉和铝粉
B.向某无色未知溶液中加入BaCl2溶液,证明存在SO42-
C.将H2、O2的混合气体通过盛有灼热氧化铜的试管,以除去氢气
D.用过滤的方法分离NaCl和NaNO3d的混合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com