
合题目要求的。
27. (8分)钢铁工业是国家工业的基础。2008年我国粗钢产量近5亿吨,居世界首位,某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请你回答下列社会实践活动小组感兴趣的问题:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石 吨。(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到1g白色沉淀。
①计算此钢样粉末中铁和碳的质量之比。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:(标准状况下,2gH2的体积为22.4L)

请根据表中数据计算稀硫酸中H2SO4的质量分数为 。
③若在实验Ⅱ中继续加入mg钢样粉末,请用含m的代数式表示:反应结束后剩余的全部固体质量为只写出最后结果即可)
2010年全国初中学生化学素质和实验能力竞赛
26.(4分) 右图是给病人输液用的氯化钠注射溶液的标签。
(1)要配置2000mL这种注射溶液(密度为1g/cm3), 需要氯化钠多少克?
(2)某同学为测定该氯化钠注射液是否达标,取该氯化钠注射液130g于烧杯中,然后滴入足量的AgNO3溶液,充分反应后,过滤得到白色沉淀2.87g。请你通过计算,判断该氯化钠注射液是否符合上的要求。
25.(9分)某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
[实验原理]Na2CO3+H2SO4 = Na2SO4 + H2O + CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
[实验装置]

[实验步骤]
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:
;
干燥管C的作用是
E装置的作用是 。
步骤③中鼓气的目的是
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是
。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
|
氯化钠注射溶液 |
|
[规格]500mL:4.5g (0.9%) [适应症]各种原因所致的失水等 [用法]静脉滴注 |
24.(8分)下图是氧化沉淀法生产复印用Fe3O4粉的工艺流程简图,根据要求回答问题。

(1)铁的另两种常见氧化物的化学式是 。
(2)副产品P是 ,由溶液N获得该副产品的操作顺序是b→ → →d。
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
|
Fe3O4的过程中发生的反应为Fe(OH)2 + 2Fe(OH)3 === Fe3O4 + 4H2O,控制“一定量空气 ”的目的是 ,
沉淀M中Fe(OH)2 和Fe(OH)3的最佳质量比为 。
22.(4分)模拟酸雨形成的流程如下图所示。硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。试填空:
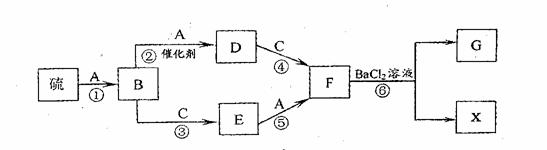
(1)E的化学式为: 。 (2)反应①的化学方程式为: 。 (3)反应④的化学方程式为: 。
(4)反应⑥的化学方程式为: 。
 23.(8分)为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作为反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,且两个容器间的导管足够粗,保持空气正常流动。请回答下列问题:
23.(8分)为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作为反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,且两个容器间的导管足够粗,保持空气正常流动。请回答下列问题:
(1)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明__________________________________;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为:____________________________________________________;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为__________________________________________;
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:_______________________________________________。
21.(6分)经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明:
(1)使用催化剂,能改变化学反应的速率;
(2)反应物的量不同,生成物可能不同;
(3)反应物的含量不同,反应现象可能不同:
20.(5分)已知:镁+氧气 氧化镁(固体)镁+氮气 氮化镁(固体)
 (1)在做测定空气中氧气含量的实验时, (填能或不能)用铁丝代替红磷,原因是 。
(1)在做测定空气中氧气含量的实验时, (填能或不能)用铁丝代替红磷,原因是 。
(2)某同学根据已知条件的提示,对实验所用的药品进行了更换,用了木炭、硫、镁中的一种药品进行实验,实验也取得了成功,猜想他用到的实验药品是 。请简述实验过程
。
18.(6分)复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①氯化钡溶液与硫酸钠混合: ;
②碳酸钾溶液与稀盐酸混合: ;
③氢氧化钡溶液与稀硝酸混合: 。
(2)你想过上述复分解反应为什么能够发生吗? 这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如上述反应①中,实际参加反应的离子是Ba2+和SO42 一,而Cl一、Na+则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是 ;
上述反应③中实际参加反应的离子是 。
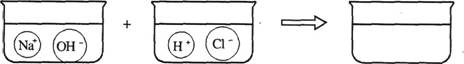
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图。
19(6分)某课外活动小组为测定铜锌合金粉末中铜的质量分数设计了下列实验:
①称取ag样品放入烧杯,滴入足量稀盐酸。
②取一张质量为bg的滤纸,制作并安装好过滤器。
③待①中反应充分后,过滤。
④取沉淀连同滤纸放在干燥器中干燥后,称量,质量为cg。
回答下列问题:
(1)称量样品时,应把样品放在托盘天平的 盘里。
(2)如何判断①中反应已进行充分?
。
(3)过滤中发现滤液出现浑浊,应如何处理? 。
(4)整个实验过程中用到的玻璃仪器有烧杯、胶头滴管、 、玻璃棒、干燥器等。
(5)通过上述实验测得的铜的质量分数是(用a、b、c表示) 。
(6)老师指出,③、④之间缺少一个步骤,使得实验结果偏大。该步骤是 。


17.(2分) 粉笔是教室内空气的主要污染源(可吸入颗粒物),粉笔的生产过程是:

(1)写出熟石膏变为生石膏的化学方程式_________________ ___________________。
(2)在熟石膏中加入少量的甘油和纯碱,可制成“无尘”粉笔。这是利用甘油吸湿性很强的性质,可使粉笔因潮湿而不飘尘,而加入纯碱的作用是提高粉笔的硬度。其原理用化学方程式表示为_______________________________________ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com