
1.已知集合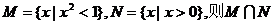 = ( )
= ( )
A. B.
B. C.
C.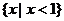 D.
D.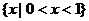
20.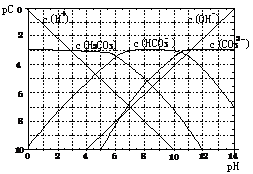 (8分)pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC= -lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为:CO2+H2O
(8分)pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC= -lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为:CO2+H2O H2CO3
H2CO3 H+ +HCO3-
H+ +HCO3- 2H++CO32-。下图为H2CO3溶液的pC-pH图。请回答下列问题:
2H++CO32-。下图为H2CO3溶液的pC-pH图。请回答下列问题:
(1)在pH=0-4时,H2CO3溶液中主要存在的离子为: ;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是
小于3的原因是
;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是
19.(10分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=1.7×10-5mol/L,Kb(NH3·H2O)=1.7×10-5mol/L。现有常温下1mol/L的醋酸溶液和1mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式为表示为 ,
相同条件下,该浓度的氨水的pH= (用含a的代数式表达)。
(2)将上述两种溶液等体积混合,所得溶液的pH= 。
(3)向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解,
甲同学的解释是: Mg(OH)2(固体) Mg2+ +2OH- ①
Mg2+ +2OH- ①
NH4+
+H2O NH3·H2O
+ H+ ②
NH3·H2O
+ H+ ②
H+ + OH- == H2O ③
由于反应③的发生,使平衡①右移,沉淀溶解。
乙同学的解释是: Mg(OH)2(固体) Mg2+ +2OH- ①
Mg2+ +2OH- ①
NH4Cl=== NH4+ + Cl- ②
NH4++
OH-  NH3·H2O ③
NH3·H2O ③
由于反应③的发生,使平衡①右移,沉淀溶解。
已知在一定温度下,稀醋酸和稀氨水的电离度相等。请你用一种试剂,设计一个实验,证明甲或乙的观点的正确性,写出实验步骤和实验结论。
。
18.(10分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________________________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(选填>、<、=)。
乙方案中,说明HA是弱电解质的现象是_________(多选扣分)。
(a)装HCl溶液的试管中放出H2的速率快 (b)装HA溶液的试管中放出H2的速率快
(c)两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处_____________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:
___________________________________________________________________。
17.(6分)为证明相同物质的量的盐酸和醋酸分别与镁粉反应生成氢气的体积(同温同压)相同,但两者的反应速率不同,某化学学习小组用镁粉、盐酸、醋酸溶液等为原料和量筒等仪器设计了一个对比实验,实验装置如右下图所示。请回答下列问题:
(1)该实验对镁粉、盐酸、醋酸溶液的要求有
。
 (2)实验时在量筒中能观察到的现象有:开始
(2)实验时在量筒中能观察到的现象有:开始
时 ,
盐酸几乎完全反应时 ,
最后 。
(3)通过这个实验,在一定意义上还能说明
。
16.(6分)称取三份锌粉,分盛在三只锥形瓶中,按下列要求另加物质后,塞上带导管的塞子,测定生成H2的体积。锥形瓶甲中加入pH=2的盐酸10mL,乙中加入pH=2的醋酸10mL,丙中加入pH=2的醋酸10mL及少量CuSO4粉末。若反应终了,生成H2体积相同,且锌没有剩余。请在小题⑴、⑵、⑶中用>、=或<回答:
(1)开始时反应速率υ的大小关系为 。
(2)三只锥形瓶中参加反应的锌的质量m大小关系为 。
(3)在反应停止后,甲、乙溶液中c(Cl-) c(CH3COO-)、c(OH-)甲 c(OH-)乙。
(4)简要说明在反应过程中乙、丙中反应的速率不同的理由是 。
(5)若开始时,在甲乙锥形瓶中分别加水稀释至100mL,此时乙锥形瓶中溶液的pH范围是 。
15.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
B.物质的量浓度c(甲)>10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
14.pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX一定是弱酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是强酸 D.反应开始时二者生成H2的速率相同
13.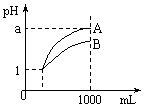 室温下,pH=1的两种酸溶液A、B各1
mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
室温下,pH=1的两种酸溶液A、B各1
mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.稀释后,a可能大于4。
12.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3- 既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O HClO+OH-是酸碱反应
HClO+OH-是酸碱反应
C.2Na+2H2O = 2NaOH+H2↑是酸碱反应
D.碱性强弱顺序为:C2H5O- > OH- > C6H5O-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com