
31. 工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充水分,也无
多余的水分,所用硝酸溶液中溶质的质量分数应为…………………………………( )
A. 30% B. 63% C. 70% D. 无法计算
30.鉴别下列各组物质,选用试剂(括号内的物质)正确的是…………………………………( )
A.氢氧化钠溶液和澄清石灰水(稀盐酸)
B.氯化钠溶液和稀盐酸(无色酚酞)
C.硝酸铵固体和氢氧化钠固体(水)
D.硬水与软水(肥皂水)
29.下表表示夏季某些湖泊随水深不同,水温和水中溶解氧的变化情况。收集这些数据是为了研究一些问题。下列问题中,不属于该项研究的是……………………………………………( )
|
水深(m) |
水面 |
1 |
3 |
5 |
7 |
9 |
11 |
13 |
15 |
17 |
19 |
21 |
|
水温(L) |
23 |
22 |
21 |
20 |
15 |
10 |
6 |
5 |
5 |
4 |
4 |
4 |
|
溶解氧(mg/100mL) |
12 |
12 |
11 |
9 |
6 |
4 |
3 |
3 |
3 |
2 |
2 |
2 |
A.鱼有时游到湖面甚至将嘴深处湖面进行呼吸的原因是什么
B.水温和溶解氧与阳光能射入湖水的深度之间的关系是什么
C.浮游植物主要在近水面出生长的原因是什么
D.湖泊中的溶解氧主要是来自空气中的氧吗
28. 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列有关说法中,正确的是…………………………………( )
A.滤出的固体中一定含有银和铜,一定不含铁
B.滤出的固体中一定含有银,可能含有铜和铁
C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜
D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜
意,请将正确选项的字母填在该题后的括号内。错选得0分,漏选且正确得1分)
27.将一套如图4所示的密闭装置放在天平上,使天平平衡,经过一段时间后,出现的情况是……( )
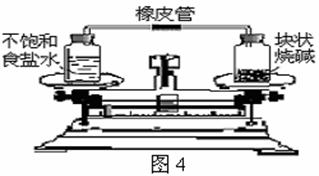
A.指针偏左,食盐溶液一定变浓,烧碱变质
B.指针偏左,食盐溶液一定变浓,烧碱潮解
C.指针偏右,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定饱和,烧碱潮解
26.(8分) 我国目前使用的燃料主要是煤和石油,含有硫的煤燃烧时生成的SO2会污染空气。
(1)某火力发电厂每天燃烧含硫1.6%的煤100 t,若煤中的硫全部转化为SO2,则该厂每天产生SO2 ----------------- t。为防止SO3污染,可将SO2通入石灰乳中生成Ca(HSO3)2,则该反应的化学方程式为 。
(2)国家标准规定工业废气中SO2含量不得超过0.15 mg/m3。工业上测量SO2的含量时,可以根据反应:SO2+2H2O+I2=H2SO4+2HI。现取该厂废气样品1000 L,用0.0254%的碘(I2)溶液2g刚好完全反应。试计算该厂排放的废气中SO2的含量是否符合国家标准。
25.(6分)青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。
(1) 30g尿素中含氮元素_______________克。
(2) 已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?
(3) 请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄入多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。
|
食物 |
白面 |
鸡蛋 |
瘦猪肉 |
牛奶 |
|
蛋白质含量 |
10% |
14% |
20% |
3% |
24.(7分)化学科代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签。到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究。
(1)进行猜想:
①科代表小聪猜想:活动性X大于Y。
②小明同学猜想:活动性Y大于X。
(2)设计实验方案、进行实验、获得知识。完成如下实验报告,并回答后续有关问题。
|
①实验步骤 |
②实验操作 |
③结论 |
|
__ __ |
金属Y表面无明显变化,金属X的表面有气泡冒出。将燃着的木条放在装金属X的试管口,气体燃烧 |
__ 科代表小聪的猜想:_______ (“正确”或“不正确”) |
(3)上述实验之前,实验老师只知道X、Y是银铁中的各一种,则根据实验结果说明Y就是_______。实验室急需一定量的Y粉末,科代表小聪认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化学方程式表示)____________________________________________。
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂质试剂____________________。
23.(9分)维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。 .
.
[实验目的]测定不同饮料中维生素C的含量。 .
.
[实验原理] .(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
.(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色; .
.
(2)淀粉遇到碘水变 ___ 色。 .
.
[实验试剂]碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水 .
.
[实验过程] 步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液, .③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
.③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。 .
.
步骤2:用4支相同的胶头滴管分别向①-④支试管中逐滴滴加碘水至刚好变色,并记录滴数。 .
.
[实验记录] .
.
|
测定物质 |
① |
② |
③ |
④ |
|
滴入碘水的数量(滴) |
1 |
8 |
15 |
5 |
试回答下列问题: .
.
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高; .
.
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:  . ____________________________________;
. ____________________________________; .
.
 (3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。 .
.
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同 .
.
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水 .
.
[回顾与反思]实验中所用的淀粉溶液的作用是 _____
。 .
.
22. (10分) 小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
(10分) 小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ______________________;
(2)B中发生的反应的化学方程式为:______________________ ______________________;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是:____________________________;
(4)如何检验该装置的气密性:______________________________________________________;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 _______________________________________________;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: _________________;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ____________;理由是_____________________________ ______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com