
7、已知低温下有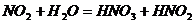 ,结合所学知识,推断下列结论正确的是:
,结合所学知识,推断下列结论正确的是:
①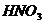 比
比 更不稳定 ②
更不稳定 ② 分解产物为
分解产物为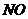 和
和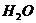
③ 分解产物为
分解产物为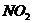 、
、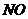 和
和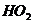
④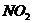 与
与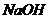 溶液反应的生成物为
溶液反应的生成物为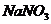 、
、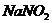 和
和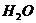
A、①②③④ B、②③④ C、③④ D、④
6、已知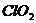 常温下呈气态,其分子构型与水分子相似,在自然环境中
常温下呈气态,其分子构型与水分子相似,在自然环境中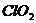 最终变为
最终变为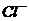 。下列说法正确的是:
。下列说法正确的是:
A、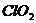 的分子结构呈V型,属非极性分子
的分子结构呈V型,属非极性分子
B、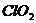 中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是
中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是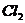 的5倍
的5倍
C、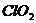 、
、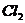 的稀溶液用于环境消毒,对人体无任何危害
的稀溶液用于环境消毒,对人体无任何危害
D、常用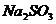 在
在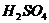 存在条件下,还原
存在条件下,还原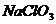 来制
来制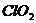 ,化学方程式为:
,化学方程式为:
5、有人认为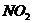 之所以称为混合酸酐,是因为:
之所以称为混合酸酐,是因为:
①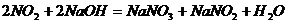
②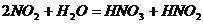
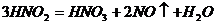
③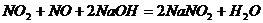
你认为能正确描述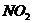 是混合酸酐的化学方程式是:
是混合酸酐的化学方程式是:
A、①②③ B、②③ C、①③ D、①②
4、吸入人体内的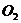 有2%转化为活性氧(
有2%转化为活性氧(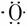 ),活性氧能加速人体衰老,目前正尝试用亚硒酸钠
),活性氧能加速人体衰老,目前正尝试用亚硒酸钠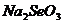 (硒ⅥA族)消除活性氧,下列说法不正确的是:
(硒ⅥA族)消除活性氧,下列说法不正确的是:
A、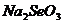 溶液的PH>7 B、消除活性氧时,
溶液的PH>7 B、消除活性氧时,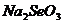 是还原剂
是还原剂
C、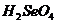 酸性比
酸性比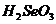 强 D、
强 D、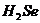 稳定性比
稳定性比 强
强
3、下列试剂存放时,可用水作保护剂的是:
A、碘 B、溴 C、钠 D、白磷
2、强热硫酸亚铁固体可发生如下反应: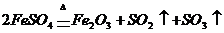 ,若将此反应生成的气体通入
,若将此反应生成的气体通入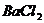 溶液则:
溶液则:
A、析出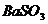 沉淀 B、析出
沉淀 B、析出 沉淀 C、溢出
沉淀 C、溢出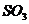 气体 D、溢出
气体 D、溢出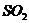 气体
气体
1、下列物质能使品红溶液褪色的是:①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A、①③④ B、②④⑤ C、①②③④ D、①②③④⑤
28.(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 ▲ _极相连,阴极上的电极反应式为 ▲ 。
电解过程中,硫酸铜的浓度会 ▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: ▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
|
序号 |
反应 |
化学平衡常数 |
|
1 |
Au
+ 6HNO3(浓) Au(NO3)3
+ 3NO2↑+ 3H2O Au(NO3)3
+ 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 ▲ 。
 (2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为 ▲ mol·L-1 ,Fe2+的浓度为 ▲ mol·L-1
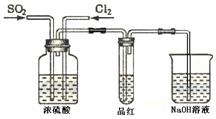
27.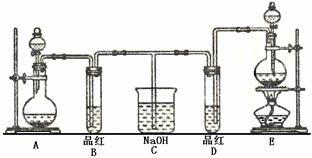 (14分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
(14分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 ▲ 装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是 ▲ 。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B: ▲ ,D: ▲ 。
(3) 装置C的作用是 ▲ 。
 (4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
(4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ▲ 。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ▲ ,并写出其相应的离子方程式: ▲ 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: ▲ 。
26.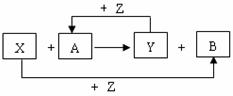 (16分)X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物。它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
(16分)X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物。它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
(1)画出Z的原子结构示意图 ▲ ;
(2)当X为金属,Y为非金属时,A可能的电子式
为 ▲ 或 ▲ ;
(3)当X为非金属,Y为金属时,X可能的化学式为 ▲ 或 ▲ ;
(4)当X与Y均为金属时,写出X与A反应的化学方程式 ▲ ;
(5) 当X与Y均为非金属时,若X与Y同主族,写出X与A反应的化学方程式 ▲ ;
若X与Y不在同一主族,写出X与A反应的化学方程式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com