
24.(15分)物质A是从茶叶中提取出的芳香族化合物,A分子中苯环上有2个取代基,取代基不含支链,且处于苯环的对位,A、B遇FeCl3溶液均能发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1)A的结构简式是 ▲ ;1mol A与足量溴水反应最多可以消耗 ▲ mol Br2 ;
C中含氧官能团的名称是 ▲ 。
(2)写出下列反应的化学方程式
A B: ▲ ;
E F: ▲ ;
(3)反应①-③中属于加成反应的有 ▲ ;(填序号)
(4)写出一种具有下列特点的C的同分异构体: ▲ 。
①所含官能团与C相同
②苯环上有2个取代基,苯环上的一氯代物有2种
③与NaOH水溶液反应后的产物经过催化氧化反应后能发生银镜反应

 台州市
2009学年第一学期
高三年级期末质量评估试题
台州市
2009学年第一学期
高三年级期末质量评估试题
化 学 答 题 卷 2010.02
第Ⅰ卷(40分)
23.(15分)草酸晶体的组成可表示为:H2C2O4·xH2O,实验室常用其加热分解制取CO气体,反应的化学方程式为:H2C2O4·xH2O
 CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
Ⅰ、下图是除去草酸分解产物中的CO2、水蒸气后得到CO,并用CO还原两通管中的CuO实验装置,回答下列问题。
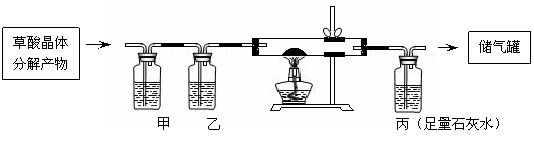
(1)在甲洗气瓶中所盛溶液是 ▲ ,在丙洗气瓶中观察到的现象是 ▲ 。
(2)CuO全部被还原后停止实验操作的步骤的有:①停止通气体,②熄灭酒精灯,③拆下实验装置, ④继续通气体到两通管冷却止。其正确的操作顺序是 ▲ 。
A.④②①③ B.①②③ C.②④①③ D.②④③
Ⅱ、为测定草酸晶体的x值,进行下列实验:
①取wg草酸晶体配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。滴定时,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验②中,滴定时,KMnO4溶液应装在 ▲ (填“酸式滴定管”、“碱式滴定管”)中。
(2)判断滴定终点的方法是 ▲ 。若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是 ▲ 。
(3)下列操作会引起测得的x值偏大的是 ▲ (填选项)
A.滴定结束时俯视读数
B.滴定结束后滴定管尖嘴处还有一滴标准液悬而未滴
C.锥形瓶未干燥即装入草酸溶液
D.滴定管用蒸馏水洗净后即装入KMnO4溶液
22.(14分)PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)
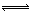 PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
|
n(PCl5) |
4 |
2.8 |
2 |
2 |
(1)已知上述反应在温度较高时才能自发进行,则a ▲ 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 ▲ 。
210℃时该反应的平衡常数K= ▲ 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 ▲ (填“增大”、“减少”或“不变”)。
 (4)欲增大该反应的K值,可采取的措施有(填序号) ▲ 。
(4)欲增大该反应的K值,可采取的措施有(填序号) ▲ 。
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
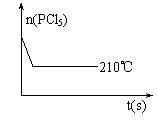
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图
中补画出该反应在160℃时PCl5物质的量的变化曲线。
21.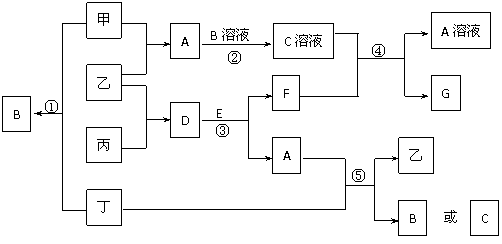 (16分)下图中的所有物质均由短周期元素组成。其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体、丁为黄绿色气体。丙是常见金属,广泛用于航天、航空工业,工业上从海水中提取G后再通过电解G制取丙、同时得到副产物丁。A、E的分子均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E常温下是无色无味的液体。框图中各物质转化所涉及的条件均已省略。回答下列问题:
(16分)下图中的所有物质均由短周期元素组成。其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体、丁为黄绿色气体。丙是常见金属,广泛用于航天、航空工业,工业上从海水中提取G后再通过电解G制取丙、同时得到副产物丁。A、E的分子均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E常温下是无色无味的液体。框图中各物质转化所涉及的条件均已省略。回答下列问题:
(1)反应①-⑤中属于氧化还原反应的是 ▲ (填序号)。
(2)画出丙的原子结构示意图 ▲ ,写出A的电子式 ▲ ,写出A、B的等电子体(原子数和电子数均相等的粒子) ▲ 、 ▲ (用化学式表示)。
(3)按要求写出下列化学方程式或离子方程式:
①C的水溶液显酸性,用离子方程式解释之 ▲ ;
②过量的A与丁反应的化学方程式 ▲ ;
(4)说出丁在工业生产或生活中的一种用途 ▲ 。
20.1.28g Cu完全溶于一定量的浓HNO3中,生成的气体刚好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为
A.0.16g B.0.02mol C.0.32g D.0.224g
第II卷 (非选择题 共60分)
19.新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-=LiFePO4 负极 Li-e-= Li+。下列说法中正确的是
A.充电时动力电池上标注“+”的电极应与外接电源的正极相连
B.充电时电池反应为FePO4+Li = LiFePO4
C.放电时电池内部Li+向负极移动
D.放电时,在正极上Li+得电子被还原
18.室温时,1mo1·L-1某一元弱酸的电离度为α,下列叙述正确的是:
A.室温时,该一元酸的电离常数K = α2
B.100℃时,若α=0.1%,则室温时α﹥0.1%
C.室温时,若α=0.1%,则室温时1mo1·L-1该酸的pH为3
D.在该酸溶液中加入少量其钠盐晶体,则α减少、pH增大、K减少
17.2009年甲型H1N1流感疫情在全球暴发,继“非典”之后,又一场抗击全球性传染病的战斗打响了。我国莱茵生物公司从中药八角中提取莽草酸,再经过十几步反应合成的达菲因此变得供不应求。已知莽草酸和达菲的结构式如下。
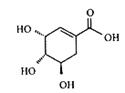
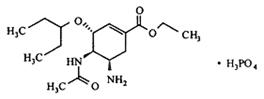
莽草酸 达菲
下列关于莽草酸和达菲判断不正确的是
A.它们都能使溴的四氯化碳溶液褪色
B.莽草酸的分子式为C7H10O5
C.达菲在热的NaOH溶液中不能稳定存在
D.达菲的分子中含有酯基、肽键、氨基、苯环等结构
16.短周期元素X、Y、Z原子序数依次递增且原子序数和为32, Y、Z在同一周期但不相邻,Z的最外层电子数等于其电子层数。下列有关叙述不正确的是
A.X、Y两元素能形成化合物Y2X、Y2X2
B.Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应
C.Y、Z所在周期的所有元素中Y的金属性最强
D.X元素形成的单质不可能存在同素异形现象
15.下列有关离子浓度的分析,正确的是
A.CH3COONa溶液:c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
B.盐酸与NH4Cl的混合溶液:c(NH4+)+ c(H+) =c(OH-)+c(Cl-)
C.在Na2CO3 溶液中:c(Na+)= c(CO32-)+ c(HCO3-)+c(H2CO3)
D.相同物质的量浓度的(NH4)2CO3、Na2CO3、NaHCO3三种溶液中c(CO32-)相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com