
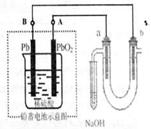
19.用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示
(a、b为石墨电极)。下列说法中正确的是 ( )
A.铅蓄电池放电时,只有负极(Pb)的质量增加
B.铅蓄电池充电时,A极应与外电源负极相连
C.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,
说明当其它条件相同时Br-的还原性强于Cl-
D.当b极产生0.01mol气体时,铅蓄电池中消耗0.01molH2SO4
18.为检验某病人血液中含钙量,现取10mL血液样品稀释后用草酸铵[(NH4)2C2O4]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/L KMnO4溶液(生成Mn2+、CO2、H2O)恰好消耗1.6mL,则该病人血液中含钙量为 ( )
 A.2.4g/L B.8g/L C.6g/L D.12g/L
A.2.4g/L B.8g/L C.6g/L D.12g/L
17. 下列离子方程式正确的是 ( )
下列离子方程式正确的是 ( )
A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
B.用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+
C.Ca(HCO3)2溶液中加过量KOH溶液:Ca2++HCO-3+OH-=CaCO3↓+H2O
 D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
16.某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①将晶体置于试管中加热,试管口有液体生成;②待试管冷却后,加水使固体全部溶解;
③向试管中逐滴加入Ba(OH)2溶液至过量,同时加热,沉淀的物质的量先增多后减少,但最终仍有沉淀未溶解,在此过程中还有刺激性气味气体生成。根据以上实验判断,该晶体是 ( )
A.Kal(SO4)2·12H2O B.NH4Al(SO4)2·12H2O
C.(NH4)2Fe(SO4)2·6H2O D.KCl·MgCl2·6H2O
15.高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钾:2FeSO4+6Na2O2=2Na2FeSO4+2NaO2+2Na2SO4+O2↑,然后在某低温下,在高铁酸钾溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是 ( )
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成1molNa2FeSO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钾的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
14.下列说法或表示法正确的是 ( )
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)=====C(金刚石);△H+1.19kJ·mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·mol-1
13. 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37°C时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37°C时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
A.CO与HbO2反应的平衡常数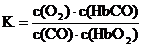
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
12.已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质质量分数将 ( )
A.大于40% B.等于40% C.小于40% D.无法确定
11.对数据的分析归纳可得到科学的结论和规律。下列为某同学对数据的利用情况,其中不正确的是 ( )
A.根据非金属单质与氢气化合生成1mol产物时反应热的大小推测生成物的稳定性
B.用沸点数据推测用蒸馏法分离两种液体混合物的可能性
C.用熔点数据分析不同分子的稳定性
D.用同周期的元素的原子(离子)半径数据推断某些原子(离子)氧化性或还原性的相对强弱
9.下列实验不能达到预期目的是 ( )
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等物质的量浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
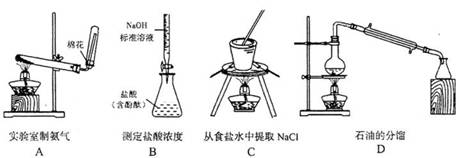 10.下列实验装置设计正确,且能达到目的的是:
10.下列实验装置设计正确,且能达到目的的是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com