
10.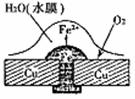 (福州三中理科综合模拟考 2009-5-26)铜板上铁铆钉处的腐蚀原理如右图所示,下列有关说法中,错误的是 (
D )
(福州三中理科综合模拟考 2009-5-26)铜板上铁铆钉处的腐蚀原理如右图所示,下列有关说法中,错误的是 (
D )
A.正极电极反应式为:O2 +2H2O+4e-= 4OH-
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铁先被腐蚀
D.此过程中电子由铜板流向铁
11.(河北省唐山市2008-2009学年度高三第三次模拟考试)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH溶液,其充、放电按下式进行:B
KOH溶液,其充、放电按下式进行:B

 Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法不正确的是
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法不正确的是
A.充电时,阴极附近溶液的碱性增强
B.放电时,电解质溶液中的OH-向正极移动
C.充电时,阳极反应:Ni(OH)2-e-+OH+=NiO(OH)+H2O
D.放电时,负极反应:Cd-2e-+2OH-=Cd(OH)2
科网
12.(武汉市2009届高中毕业生四月调研测试)下列叙述正确的是( C )
A.在原电池的负极和电解池的阴极上发生的都是氧化反应
B.实验室用惰性电极电解Na2SO4溶液,阴、阳两极收集到的气体体积之比为1:2
C.电解稀硫酸溶液,可能发生反应:
D.在铜的电解精炼过程中,电解质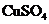 溶液中
溶液中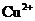 浓度始终保持不变
浓度始终保持不变
 学8.(湖北省黄冈中学2009届高三第二次模拟考试) 铅蓄电池是最重要的二次电池,其正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是硫酸溶液,下列说法不正确的是
学8.(湖北省黄冈中学2009届高三第二次模拟考试) 铅蓄电池是最重要的二次电池,其正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是硫酸溶液,下列说法不正确的是 A
A
A.充电时转移1mol电子则生成0.5mol
H2SO4
B.放电时正极的电极反应为:PbO2
+ 4H+ + SO42- + 2e- = PbSO4
+ 2H2O
C.充电时,电池上标注“+”的电极应与外接电源的正极相连
D.放电时,Pb失电子发生氧化反应
6.(江苏省启东中学2009届高三最后一考 )金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+=,下列叙述正确的是( B
)
)金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+=,下列叙述正确的是( B
)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B.电解后,电解槽底部的阳极泥中只有Cu和Pt
C.电解后,溶液中存在的阳离子只有Fe2+ 和Zn2+
D.电解过程中,阳极质量的减少与阴极质量的增加相等
5.(南京市2009届高三第一次调研测试)某燃烧电池所用的原料为H2和空气(含一定量的CO2),电解质为熔融的K2CO3。电池的总反应为:2H2+O2==2H2O,负极反应为:H2+CO32--2e-==H2O+CO2。
下列说法中正确的是C
A.正极反应为:4OH-+4e-=2H2O+O2↑
B.电池放电时,电解质中CO32-的物质的量将减小
C.放电时,电解质中CO32-向负极移动
D.电池工作时,电子从正极经外电路流向负极
 10.(江西省南昌市2009届高三第二次模拟测试)右图是某空间站能量转化系统局部示意图,其中燃料电池采用KOH溶液作电解质。下列有关说法正确的是 ( C )
10.(江西省南昌市2009届高三第二次模拟测试)右图是某空间站能量转化系统局部示意图,其中燃料电池采用KOH溶液作电解质。下列有关说法正确的是 ( C )
A.系统持续运行中不断消耗水
B.燃料电池的能量实际上是来自于水
C.水电解系统的阳极反应为:4OH- 一4e-
2H2O+O2↑
D.燃料电池放电时,负极反应为:2H++2e- H2↑
12. 右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解质溶液,
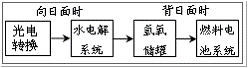 下列有关说法中不正确的是B
下列有关说法中不正确的是B
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应: 4OH-- 4e- =2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
14.(苏北四市2008--2009学年度高三年级第二次调研测试)银锌碱性蓄电池是一种可以反复充电、放电的装置。电池放电时的反应原理是:
 现用该蓄电池电解含有O.04 mol CuS04和0.04 mol NaCl的混合溶液400 mL,工作一段时间后测得蓄电池消耗了0.72 g H20(电解池的电极均为惰性电极)。以下叙述不正确的是AB
现用该蓄电池电解含有O.04 mol CuS04和0.04 mol NaCl的混合溶液400 mL,工作一段时间后测得蓄电池消耗了0.72 g H20(电解池的电极均为惰性电极)。以下叙述不正确的是AB
A.该电池负极反应为
B.阳极产生的气体在标准状况下为0.448 L
C.阴极析出铜为2.56g
D.电解后溶液的pH=1(溶液的体积变化忽略不计)
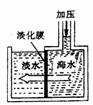 13.(上海市2009年高三十四校联考模拟试卷)海水淡化可采用右图所示的膜分离技术。对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( A )
13.(上海市2009年高三十四校联考模拟试卷)海水淡化可采用右图所示的膜分离技术。对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( A )
A.溶剂质量减少
B.溶质质量增加
C.溶液质量不变
D.溶质质量分数减小
19.(10分)
每空2分,其它合理答案酌情给分
(1)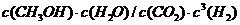
(2)CD
(3)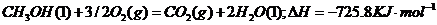
(4)甲醇、氢氧化钠、水(答出甲醇即给2分) 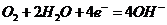
19.(厦门市2009年高中毕业班质量检查 )过度排放CO
)过度排放CO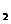 会造成“温室效应”,科学家正在研究如何将CO
会造成“温室效应”,科学家正在研究如何将CO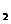 转化为可以利用的资源,其中一种方案就是将CO
转化为可以利用的资源,其中一种方案就是将CO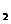 转化为可再生燃料甲醇(CH
转化为可再生燃料甲醇(CH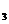 OH)。其化学方程式为:
OH)。其化学方程式为:
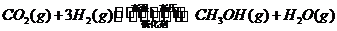
请填空:
(1)写出上述反应的平衡常数表达式K:______________________.
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实
验结果如下图所示。下列说法正确的是(填序号)___________。
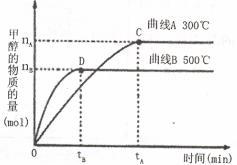
A.在300℃,从反应开始到平衡,甲醇的平均反应速率
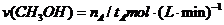
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500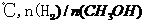 增大
增大
(3)25℃,1.01×10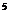 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是____________________正极的电极方程式为_________________________.
21.阳极 Fe-2e-=Fe2+ ,阴极 2H2O+2e-=H2+2OH- 。溶液的PH变化是 变大 。现象是 先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色。 ,原因是 4Fe(OH)2 +O2+2H2O+2e-=4Fe(OH)3 (用化学方程式表示)。当放出22.4升气体(标况),欲使溶液恢复原有组成应加入 H2O 。其质量是 45g 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com