
33. (16分)A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药
物,有的是香料。它们的结构简式如下所示:
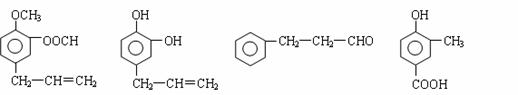

请回答下列问题:
(1)用A、B、C、D填空:①能发生银镜反应的有 。
②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 。
(2)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于 反应(填
反应类型名称)写出反应②的化学方程式:
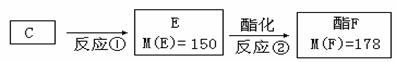
(3)同时符合下列两项要求的D的同分异构体有4种:
① 化合物是1,2-二取代苯;
② 苯环上的两个取代基分别为羟基和含有-COO-结构的基团。其中两种(G和H)结构
简式如下图所示,请写出另外两种异构体。
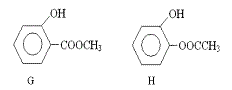
32.(16分)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·2H2O的工艺流程如下:
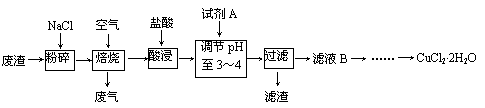
回答下列问题:
(1)焙烧过程中发生的主要反应为: CuS+ NaCl+ O2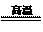 CuCl2+ Na2SO4,
CuCl2+ Na2SO4,
配平上述化学方程式。
(2)试剂A应选用 。(填编号)
①NaClO ②Cl2 ③H2O2溶液 ④浓硫酸
理由是 。
(3)滤液B中大量含有的离子有 。
 (4)为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:
(4)为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:
蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。
分析有关物质的溶解度曲线(如下图),“趁热过滤”得到
的固体是___________ ______,“冷却结晶”过程中,析
出CuCl2·2H2O晶体的合适温度为 。
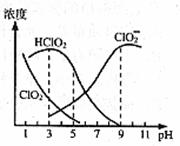
31.(16分)织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。各组分含量随pH变化情况如图所示(Cl-没有画出)。
回答下列问题:
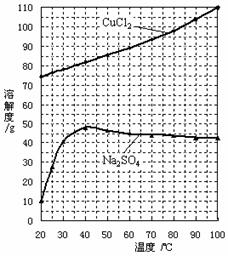
(1)NaClO2溶液中,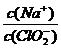 1(填“>”“=”或“<”)。
1(填“>”“=”或“<”)。
(2)往NaClO2溶液中滴入稀盐酸,依据图中数据,回答下列问题:
①当pH >6时,溶液中主要反应的离子方程式是 。
②当pH<6时,ClO2-会发生自身的氧化还原反应,放出ClO2气体,反应的离子方程
为: 。
(3)使用该漂白剂的最佳pH为 。
A.3.0 B.4.0-4.5 C.6.5-7.0 D.9.0
30.(16分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:
Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3; 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(可不写反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在, 滴加 KSCN 试剂时溶液不变红色, 则证明原固体粉末是 ,写出发生反应的离子方程式
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4 . 5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
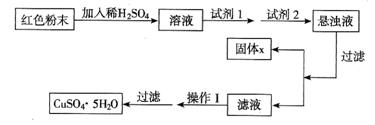 实验小组设计如下实验方案:
实验小组设计如下实验方案:
试回答:
 试剂1为 ,试剂2为 (填字母序号),固体x的化学式是 。
试剂1为 ,试剂2为 (填字母序号),固体x的化学式是 。
23.现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;
④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②
22.把l mol CO2和3mol H2通入l L的密闭容器中,在某温度下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=–49.0
kJ·mol-1
CH3OH(g)+H2O(g) △H=–49.0
kJ·mol-1
 测得CO2和CH3OH的浓度随时间变化如下图所示,下列说法正确的是
测得CO2和CH3OH的浓度随时间变化如下图所示,下列说法正确的是
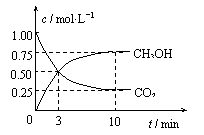
A.3min时,v正=v逆
B.0-10 min内,氢气的平均反应速率为0.225 mol·L-1·min-1
C.该温度下,反应的平衡常数K=5.3 mol-2·L2
D.若升高温度,CO2的平衡转化率大于75%
12. 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 。关于该反应的说法中正确的组合是:
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
11.下列反应的离子方程式表示正确的是
A.亚硫酰氯(SOCl2)剧烈水解生成两种酸:SOCl2+2H2O==H2SO3+2H++2Cl-
B.金属铝溶于氢氧化钠溶液:Al+2OH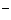 ==
==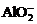 +H2↑
+H2↑
C.氨水中滴加稀盐酸:NH3+H+==NH4+
D.少量氢氧化钙溶液与碳酸氢钠溶液反应: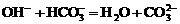
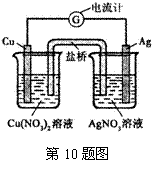
10.某原电池构造如右图所示。下列有关叙述正确的是
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
9.下列实验能达到预期目的的是( )
A.可用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物
B.实验室制取乙烯时,常含有少量的CO2、SO2及H2O(g)杂质,可依次通过高锰酸钾溶
液和碱石灰得较纯净的乙烯气体
 C.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液
C.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液
D.银镜反应实验后试管内壁附有银,可用氨水清洗
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com