
8. 在FeCl3和AlCl3的混合溶液中,先加入过量的NaI溶液,再加入足量的Na2S溶液,则所得的沉淀是( )
A. FeS、S和Al(OH)3 B. Fe2S3和I2
C. Al2S3和I2 D. Fe(OH)3和Al(OH)3
7. 取一定量CuO粉末与0.5升稀硫酸充分反应后,将一根50克铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24克,并收集到224毫升氢气(标准状况).由此推知此CuO粉末的质量为( )
A. 2.4克 B. 8克 C. 6.4克 D. 1.92克
6. 将镁、铝、铁的单质分别投入质量相等的稀硫酸中(稀H2SO4过量),反应结束后,各溶液的质量相等,则投入镁、铝、铁三者的质量关系是( )
A. 铝>镁>铁 B. 镁>铝>铁
C. 铁>镁>铝 D. 铝=镁=铁
5. 向铁和Fe203的混合物中加入足量稀H2S04, 充分反应后生成FeSO4溶液, 当生成的Fe2+和H2的物质的量之比为4:1时,反应中关系量正确的是( )
A. 被氧化的铁与被还原的铁离子物质的量之比为1:1
B. 被氧化的铁与被还原的铁离子物质的量之比为2:1
C. 被氧化的铁与被还原的铁离子物质的量之比为1:2
D. 被氧化的铁与被还原的铁离子物质的量之比为1:3
4. 含n克硝酸的稀溶液恰好和m克铁粉完全反应,若有n/4克HNO3被还原成NO,n:m可能是( )
A. 1:1 B. 2:1 C. 3:1 D. 9:2
3. 铁、镁、铝3种金属,分别和同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则参加反应的金属( )
A. 所失去的电子数目相等 B. 质量相等
C. 物质的量相等 D. 质量比是28:12:9
2. 将1.12克铁粉加入2摩/升氯化铁溶液25毫升中,充分反应后,其结果是( )
A. 铁有剩余
B. 往溶液中滴入无色KSCN溶液,显红色
C. Fe2+和Fe3+物质的量之比为6:1
D. 氧化产物与还原产物的物质的量之比为2:5
1. 由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,
则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能是( )
A. 1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3
(四)有关Fe与酸反应的问题讨论
1.与非氧化性酸反应:(如HCl、稀H2SO4)
Fe+2H+=Fe2++H2↑
取mgFe分别投入含1mol HCl和1mol H2SO4的稀酸中,放出的H2有何异同?
 分析 2HCl - Fe - H2 H2SO4
- Fe - H2
分析 2HCl - Fe - H2 H2SO4
- Fe - H2
2mol 56g 1mol 1mol 56g 1mol
1mol 28g 0.5mol
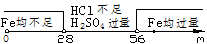
讨论:
① 当m≤28g, Fe均完全反应,放出H2量相等.
② 当m≥56g, 两种酸均能完全反应,放出H2量H2SO4是HCl的2倍.
③ 当28g<m<56g时,H2SO4中放出H2量为 mol.
mol.
HCl中放出H2量为0.5mol.
故有关系: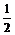 <
< <1
<1
例 4 2mol/L的盐酸与硫酸各100mL,分别加入等质量的铁粉,反应结束后,所生成的气体质量比2 :3,则向盐酸中加入的铁粉质量是多少?
解 从所生成的气体质量比即物质的量之比2 :3可知,HCl不足,H2SO4过量.设加入的Fe为 xg
(0.1×2×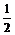 ) :
) :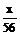 =2 :3.
=2 :3.
x=8.4(g)
2.与氧化性酸反应.(如浓H2SO4、浓、稀HNO3)前已所述随着反应条件(温度、量等)不同,可能有多种情况.Fe在反应产物中呈何价?如何定量判断呢?
请看下面一例:
2.24g Fe粉与50mL稀HNO3刚好完全反应(HNO3还原产物是NO),向反应后所得溶液加入50mL0.2mol/L的KI溶液,I-恰好被氧化成单质碘.求原稀HNO3的物质的量浓度.
解 Fe与HNO3恰好反应后的溶液能与I-反应,说明Fe与HNO3反应必有Fe3+,但也可能有Fe2+.
nFe=2.24/56=0.04(mol).n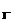 =0.05×0.2=0.01mol.
=0.05×0.2=0.01mol.
若Fe全部与HNO3反应转变成Fe3+.
则 Fe3+与I-反应时
Fe3+ - Fe2+ -
e
I- - 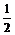 I2 -e
I2 -e
0.04 0.04 0.01 0.01
因 0.04>0.01.
故假设不成立.即说明Fe与HNO3反应生成Fe3+和Fe2+.
利用终态法可直接求解.最终生成的为Fe2+.设有x mol HNO3被还原.
0.04×2+0.2×0.05=x×3(电子守恒)
x=0.03(mol)
最终溶液为Fe(NO3)2、KNO3。
n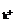 +2n
+2n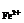 =n
=n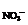
0.01+2×0.04=n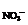
n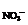 =0.09(mol)
=0.09(mol)
总nHNO3=0.09+0.03=0.12(mol)
C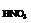 =
=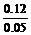 =2.4(mol/L)
=2.4(mol/L)
当堂反馈
1.下列叙述中正确的是
A.含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
2.(2005年上海,17)某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol/L
3.在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当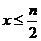 时,反应的离子方程式为__________________________。
时,反应的离子方程式为__________________________。
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl- 时,x与n的关系为_____。
(3)当Fe2+ 和Br- 同时被氧化时,x与n的关系是_______________。
(4)当x=n时,反应后氧化产物的物质的量为________________。
(5)往50.0 mL FeBr2 溶液中缓慢通入1120 mLCl2(标准状况),溶液中还原性离子只有2/3溴离子未被氧化。求原FeBr2溶液的物质的量浓度。
课后练习
典型例题
|
|


 不变色 血红色溶液
不变色 血红色溶液
|
|

 未知溶液
火焰呈浅紫色
未知溶液
火焰呈浅紫色

|


|

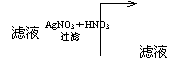

 |
|||||||
|
|||||||
 |
|||||||
 |
|||||||
|
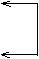


由以上实验事实,请回答:
(1)未知溶液中肯定存在的离子有________________
(2)SO42-、SO32-能否肯定其存在_____(填“能”或“不能”)理由是__________
(3)判断Fe2+、Fe3+是否存在的依据是___________
(4)写出生成D的离子方程式____________
解析 焰色反应实验可肯定K+存在;与KSCN溶液混合不变色,但加入溴水却出现血红色,这说明Fe2+存在而Fe3+不存在;滤液加AgNO3和HNO3.出现白色沉淀B,且过滤以前又未加过Cl-,这证明未知溶液中含有Cl-;根据沉淀D的生成及其转变,可推知溶液中有Al3+.
又白色沉淀A为BaSO4,因为HNO3的氧化性.可将SO32-氧化成SO42-,似乎不能确定原样品存在的是SO32-还是SO42-.但是SO32-与Fe2+、Al3+不能共存在,所以仍应肯定原样品存在SO42-.
生成D的离子方程式为:AlO2-+H++H2O=Al(OH)3↓
例2 某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( A、C )
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+
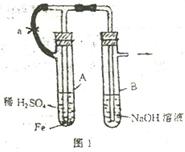
例3 根据下述实验装置和操作,回答有关问题.
(1)按图1中所示装置,用两种不同操作分别进行实
验,观察B管中现象.
操作1 先夹紧止水夹a,再使A管开始反应.实验中
在B管中观察到的现象是_________________
____________________________.B管中发生的
反应的离子方程式是:
操作2 打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a.实验中在B管中
观察到的现象是_____________________________.
B管中发生的反应的离子方程式是:_____________________.
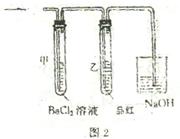 (2)上述装置的实验结束后,取A管内反应所得溶液,
(2)上述装置的实验结束后,取A管内反应所得溶液,
隔绝空气小心蒸干后再高温煅烧(有关装置及操作
均已略去),最后留下红色固体.将分解时产生的气
体按图2所示装置依次通过洗气装置,结果试管甲
内出现白色沉淀,试管乙内溶液红色褪去.回答:
问题1 用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明).
问题2 根据实验现象,写出图1中A管内溶液蒸干后,在高温煅烧分解时所发生的
氧化还原反应的化学方程式.
解析 (1)操作1 因夹紧a,使Fe与H2SO4反应产生的H2无法进入B.A容器中液面上压强增大,可将A中反应后溶液压入B中,当NaOH足量时,Fe2+与OH-反应产生白色沉淀,迅速变成灰绿色,最后变成红褐色.
Fe2++2OH-=Fe(OH)2↓, 4Fe(OH)2+O2+2H2O=4Fe(OH)3
操作2 先打开a反应一段时间,使反应产生的H2能导入B中,H2不溶于NaOH溶液,并能驱赶其中的空气,故可看到B中有气泡冒出.当再夹紧a后,又可观察到A中的溶液压入到B中,但生成的白色沉淀较长一段时间不变色.
Fe2++2OH-=Fe(OH)2↓
|
 问题2 2FeSO4 Fe2O3+SO2↑+SO3↑
问题2 2FeSO4 Fe2O3+SO2↑+SO3↑
(红)
想一想 将一小粒Na投入到盛有FeCl2溶液的烧杯中,能观察到什么现象?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com