
能源可分为两类:一是再生能源,如:太阳能、电能、水能、生物能、风能、潮汐能、波浪能、地热能等;二是非再生能源,如:煤炭、石油、天然气、核能等。
30.(14分)黄铜矿(主要成分为CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的有关反应为:8CuFeS2+21O2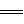 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。
已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素是________(填元素符号)。
(2)上述冶炼过程中会产生大量SO2。下列处理方案中不合理的是_______(填字母代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制取Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,有关离子方程式为:
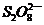 +2I-
+2I-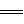 2
2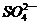 +I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示为___________
_______________________________、____________________________________.
+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示为___________
_______________________________、____________________________________.
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:a.用稀盐酸浸取炉渣,过滤.b.滤液先经过氧化,再加入过量的NaOH溶液,反应后过滤;c.将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
①b中除去Al3+的有关反应的离子方程式为_____________________________。
②2.3g黄铜矿(含CuFeS280%)理论上可制得Fe2O3____________________g
29. (13分)某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列 猜想和探究。
(13分)某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列 猜想和探究。
(1)同学们首先排除了试剂的成分是硫酸铜、硫酸铁、硫酸亚铁等的可能,理由是________________________________________________________________。
(2)取出少量溶液置于试管中,向其中滴入石蕊试液,石蕊试液呈现红色,同学们认为可以排除硫酸钠、硫酸钾等,理由是___________________________;但是不能排除是硫酸铵的可能性,其原因是(用离子方程式表示)_______________。
(3)向试管中加入锌粒,有大量无色气泡快速冒出。根据此现象,可推测溶质可能是下列物质中的___________________(填字母代号),生成气体的有关反应的离子方程式为 __________________________________________________.
A.NaHSO4 B.KHSO4 C.MgSO4 D.H2SO4 E.Al2 (SO4)3 F.(NH4)2SO4
(4)假设真正的溶质就在上述六种物质之中,请在上述探究结果的基础上,设计一个定量实验方案对试剂的成分加以确定 _______________________________________________________________。
28.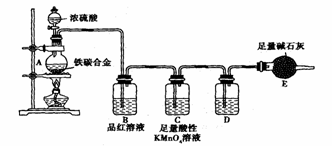
 (9分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装置引起的实验误差忽略不计)。
(9分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装置引起的实验误差忽略不计)。
Ⅰ.探究浓硫酸的某些性质
(1)称量E的质量;按照图示连接装置,检查装置的气密性。简述检验发生装置气密性的方法
_______________________ 。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为______。未点燃酒精灯前,A、B均无明显现象,其原因是:________________________
____________________________________________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中碳发生反应的化学方程式______________________________________。
B中的现象是 。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式 (只写一个)_________________________________________________________。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ.测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为________________________________________(写表达式),
(7)某同学认为上述方法较复杂,使用右图所示的装置和其他常用实验仪器测定某些数据即可。为了快速准确的计算出铁的质
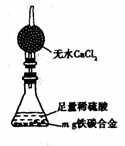 量分数,最简便的实验操作是 (填写序号)。
量分数,最简便的实验操作是 (填写序号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量
27. (15分)
(15分) 浓H2SO4和木炭在加热时发生反应的化学方程式是:
浓H2SO4和木炭在加热时发生反应的化学方程式是:
 2H2SO4(浓)+C
2H2SO4(浓)+C  CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑



 请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)

 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器 (填字母) (填字母) |
加入的试剂 |
作用 |
     |
   |
   |
13.NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含有氯原子数目为4NA
B.7gCnH2n中含有的氢原子数目为NA
C.常温下,100mL0.1mol/L醋酸溶液中含醋酸分子为O.01NA
D.一定条件下2mol二氧化硫和1mol氧气混合,反应时转移的电子数为4NA
选择题答题表:
12.下列实验操作中,先后顺序正确的是( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称量时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加氯化钡溶液,滤去沉淀后再加硝酸银溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
11.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实
验现象。图中所示的实验,点滴板上描述的现象正确的是( )
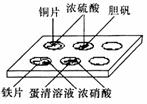 ①装有铜片的孔穴中溶液呈蓝色 ②装有胆矾的孔穴中固体的颜色变白 ③装有铁片的孔穴中溶液呈浅绿色 ④装有铁片的孔穴中溶液呈黄色 ⑤装有蛋清溶液的孔穴中呈黄色
①装有铜片的孔穴中溶液呈蓝色 ②装有胆矾的孔穴中固体的颜色变白 ③装有铁片的孔穴中溶液呈浅绿色 ④装有铁片的孔穴中溶液呈黄色 ⑤装有蛋清溶液的孔穴中呈黄色
A. ①④ B. ②③
C. ①⑤
D. ②⑤
9.下列溶液中,不能区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液
⑥品红溶液
A.①⑤ B.②③④⑤⑥ C.只有① D.①③
|
上的部分内容。据此下列说法正确的是( )
A.该试剂的物质的量浓度为9.2 mol·L-1
B.该硫酸50. 0 mL与足量的铜反应可得到标准状况下
SO2 10.3 L
C.配制200.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
7.工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理
是: 2FeSO4 = Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
A.(I)中会生成BaSO3、BaSO4两种沉淀
B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液
C.(III)的作用是检验生成的SO2气体
D.(II)所盛x应为品红溶液
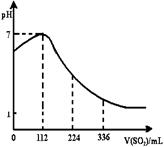
|
A.SO2是弱电解质
B.H2SO3是强酸
C.亚硫酸是比氢硫酸还弱的酸
D.原氢硫酸溶液的物质的量浓度0.1mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com