
14、A、B、C、D是中学化学中常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,他们之间存在下图所示的转化关系:
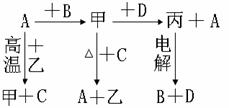
⑴元素A有可变化化合价,则单质A的名称为_______ 甲的化学式为__________ 乙的电子式为__________
⑵判断A和C的还原性强弱;A_____C(填<、>或=)
⑶写出甲和D反应的化学方程式(注明反应条件)_____________________
⑷已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式:______________
13、某固体粉末含有下列钠盐中的三种:
A、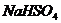 B、
B、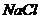 C、
C、 D、
D、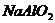 E、
E、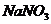 F、
F、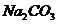
将固体溶于水中,有沉淀产生,同时有气体放出。根据上述现象推断该固体粉末的可能组成。(填写相应字母,可不填满,也可补充)
第一种情况:_________________ 第二种情况:___________________________
第三种情况:_________________ 第四种情况:___________________________
(一)、选择题:
1、第ⅡA族的铍在一定条件下可形成化合物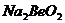 。下列有关铍及其化合物的叙述正确的是:
。下列有关铍及其化合物的叙述正确的是:
A、氧化铍不溶于盐酸 B、氢氧化铍易溶于水
C、单质铍与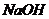 溶液反应生成
溶液反应生成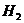 D、
D、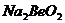 溶液呈酸性
溶液呈酸性
2、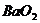 和
和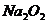 都是离子化合物,下列叙述正确的是:①
都是离子化合物,下列叙述正确的是:①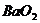 和
和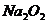 都能跟水反应放出
都能跟水反应放出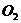 ;②
;②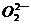 离子的电子式是
离子的电子式是 ;③
;③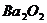 在水中以
在水中以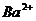 和
和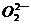 形式存在;④
形式存在;④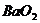 的熔点可能低于100℃
的熔点可能低于100℃
3、向100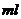 的
的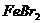 溶液中通入标准状况的
溶液中通入标准状况的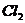 3.36L,全部被还原,测得溶液中
3.36L,全部被还原,测得溶液中 =
=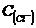 ,则原
,则原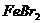 溶液的物质的量浓度:
溶液的物质的量浓度:
A、0.75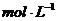 B、1.5
B、1.5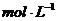 C、2
C、2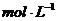 D、3
D、3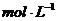
4、等体积,等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两个烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲乙两个烧杯中的反应情况可能分别是:
A、甲乙中都是铝过量 B、甲中铝过量,乙中碱过量
C、甲中酸过量,乙中铝过量 D、甲中酸过量,乙中碱过量
5、将3.5g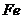 、
、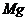 合金投到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标况下的气体V L(
合金投到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标况下的气体V L(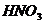 被还原为
被还原为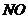 和
和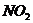 ),若向反应后的溶液中加入足量的
),若向反应后的溶液中加入足量的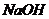 溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为8.6g。则收集到气体的体积V值可能为:
溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为8.6g。则收集到气体的体积V值可能为:
A、1.12 B、5.34 C、7.26 D、8.23
6、将溶液中的 (0.1
(0.1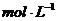 )氧化成
)氧化成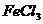 ,为不引入其他杂质,下列试剂最合适的是:
,为不引入其他杂质,下列试剂最合适的是:
A、浓硫酸 B、稀硝酸 C、双氧水 D、氯水
7、单质A能从盐溶液中置换出单质B,则下列说法不正确的是:
A、当A、B都是金属时,A一定比B活动性强
B、A、B都是非金属时,A一定比B活动性强
C、当A是金属时,B可能是金属,也可能是非金属
D、当A是非金属时,B可能是金属,也可能是非金属
8、在含有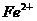 、
、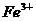 、
、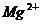 、
、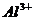 的溶液中,加入足量
的溶液中,加入足量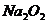 固体,充分作用后,再加入过量稀盐酸,溶液中离子数目没有变化的是:
固体,充分作用后,再加入过量稀盐酸,溶液中离子数目没有变化的是:
A、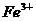 B、
B、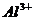 C、
C、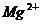 D、
D、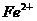
9、将一定量的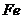 、
、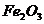 、
、 的混合物放入体积为100
的混合物放入体积为100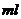 。浓度为2.2
。浓度为2.2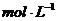 的硫酸溶液中,充分反应后生成气体896
的硫酸溶液中,充分反应后生成气体896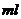 (标准状况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有
(标准状况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有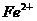 (假设滤液体积仍为100
(假设滤液体积仍为100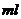 )。向滤液滴加2
)。向滤液滴加2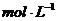 的
的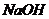 溶液前滤液中
溶液前滤液中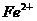 物质的量浓度为:
物质的量浓度为:
A、2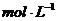 B、1.8
B、1.8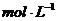 C、1.9
C、1.9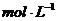 D、无法计算
D、无法计算
10、下列说法中不正确的是:
A、人类历史上使用最早的合金是青铜,目前世界上使用量最大的合金是钢
B、从金属矿石中提炼金属的一般步骤依次是:矿石的富集、精炼、冶炼
C、硫酸的消费量常被视为一个国家工业发达水平的一种标志
D、能源、信息、材料通常被称为新科技革命的三大支柱
11、现有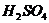 、
、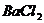 、
、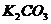 、
、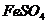 和氯水五种溶液,有如下图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是:
和氯水五种溶液,有如下图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是:
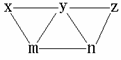 A、x一定为
A、x一定为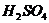 B、y一定为
B、y一定为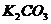
C、z可能为氯水 D、m、n必定各为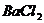 、
、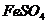 中的一种
中的一种
12、某学生为测定a、b、c、d、e五种金属的活动性顺序,做如下试验:①取少量上述五种金属投入到足量盐酸中,发现a、c、e溶解;②将上述反应液过滤,往滤液中加过量稀烧碱溶液时,发现加a的滤液中产生白色沉淀,加c的滤液中先有白色胶状物生成后又溶解,加e的滤液中白色沉淀很快变灰绿色最后变红褐色;③再将a、c两种金属片用导线连接,金属片插入盛有稀硫酸的烧杯中,c金属片上有大量气泡逸出;④用直流电电解含b、d阳离子的混合液,在阴极上首先析出d金属。根据以上试验,五种金属活动性由强到弱的顺序可能是:
A、a>c>e>b>d B、c>a>e>d>b C、a>c>e>d>b D、d>b>e>a>c
3、 写出 的化学方程式:______________________________
的化学方程式:______________________________
2、 写出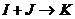 的离子方程式:___________________________
的离子方程式:___________________________
例1、有关金属元素特征的叙述正确的是:
A、金属元素的原子只有还原性,离子只有氧化性
B、 金属元素在化合物中一定显正价
C、 金属元素在不同化合物中的化合价均相同
D、金属元素的单质在常温下均为金属晶体
例2、粉末状试样A是由等物质的量的 和
和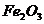 组成的混合物。
组成的混合物。
进行如下试验:
①取适量A进行铝热反应产物中有单质B生成;②另取20gA全部溶于0.15L6.0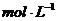 的盐酸中得溶液C;③将①中得到的单质B和溶液C反应,放出11.2L(标准状态)气体,同时生成溶液D,还残留固体物质B;④用
的盐酸中得溶液C;③将①中得到的单质B和溶液C反应,放出11.2L(标准状态)气体,同时生成溶液D,还残留固体物质B;④用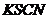 溶液检验时,溶液D不变色。
溶液检验时,溶液D不变色。
请填空:
⑴①中引发铝热反应的试验操作是___________________________,产物中单质B是_____
⑵②中发生的各反应的化学方程式是_________________________________________
⑶③中发生的各反应的离子方程式是_________________________________________
⑷若溶液D的体积仍视为0.15L,则该溶液中:
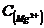 =__________,
=__________,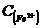 =_____________
=_____________
例3、有一透明溶液,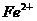 、
、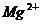 、
、 、
、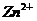 、
、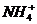 ,当加入一种淡黄色固体物质时,便有刺激性气味的混合气体放出,同时生成白色沉淀。若加入的淡黄色固体物质的量x和放出气体及产生沉淀的物质的量y,其关系如图示(
,当加入一种淡黄色固体物质时,便有刺激性气味的混合气体放出,同时生成白色沉淀。若加入的淡黄色固体物质的量x和放出气体及产生沉淀的物质的量y,其关系如图示(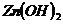 与
与 类似,也是两性氢氧化物)。试回答:
类似,也是两性氢氧化物)。试回答:
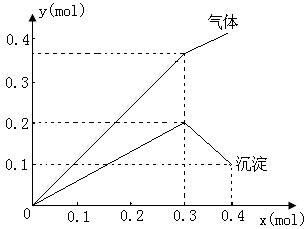
⑴淡黄色固体是__________________
⑵当淡黄色固体由0.3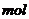 到0.4
到0.4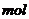 时,其化学方程式:__________________________
时,其化学方程式:__________________________
⑶溶液中所含离子及各离子物质的量之比__________________
例4、下列物质均是中学化学常见物质,转化关系图中D为红棕色金属氧化物粉末。
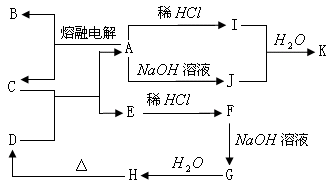
回答下列问题:
1、 写出下列物质的化学式:A________ B__________ C___________
7、金属的冶炼:
⑴原理_______________________________________
⑵方法:根据金属活动性强弱,常用以下三种方法:
A、 电解法,如:__________________________________
B、 热还原法,如:__________________________________
C、 热分解法,如:___________________________________
6、注意两个“三角”关系:
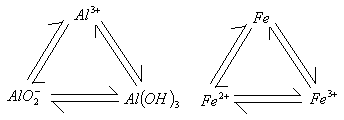
5、金属氢氧化物:
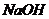 、
、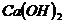 、
、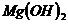 、
、 、
、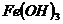 、
、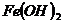 、
、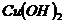
①属于强碱的是_________________________
②难溶于水的是_________________________
③受热易分解的是________________________
④易被氧化的是__________________________
⑤能经水解反应生成的是____________________
⑥和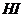 反应不能生成对应价态金属盐的是_________
反应不能生成对应价态金属盐的是_________
实验室中如何制备 和
和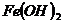 ?为什么?
?为什么?
___________________________________________________
4、金属氧化物:
金属氧化物可分为__________、__________、___________三类。
⑴碱性氧化物,如 、
、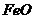 、
、 、
、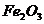 等,其性质是:
等,其性质是:
______________________________________________________
⑵两性氧化物,如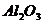 ,其性质是____________________
,其性质是____________________
⑶过氧化物,如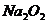 、
、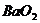 等,其晶体中存在的阳离子是_____,阴离子是___;过氧化物典型的化学性质是_____________ 原因是________________,为什么
等,其晶体中存在的阳离子是_____,阴离子是___;过氧化物典型的化学性质是_____________ 原因是________________,为什么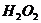 也存在此典型性质?______________________
也存在此典型性质?______________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com