
第一节 单项选择(共15小题;每题1分,满分15分)
从A、B、C、D四个选项中,选出可以填入空白处的最佳选项。
21. Such ____ medical equipment is in ____ danger of breaking down, if not taken good care
of.
A. a; the B. a; / C. /; the D. /; /
33.(16分).塑料属于合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
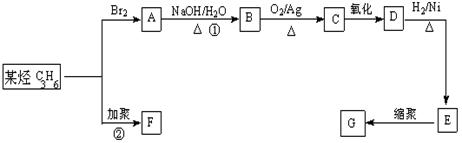
(1)写出化合物A的结构简式 ;化合物C的结构简式 ;
(2)写出化合物E分子中存在的官能团的名称 。
(3)写出反应①的化学方程式: ;
反应类型 。
(4)写出反应②的化学方程式: 。
32.(16分)钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组
成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
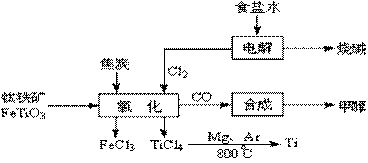









(1)电解饱和食盐水时,总反应方程是 。
 (2)写出钛铁矿经氯化法得到四氯化钛的化学方程式(不用写条件)
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式(不用写条件)
。
 (3)已知:①Mg(s) + Cl2(g)=MgCl2(s) △H =-641kJ·mol-1
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s) △H =-641kJ·mol-1
 ②Ti(s) + 2Cl2(g)=TiCl4(s) △H
= -770kJ·mol-1
②Ti(s) + 2Cl2(g)=TiCl4(s) △H
= -770kJ·mol-1
 则2Mg(s)
+ TiCl4(s)=2MgCl2(s) + Ti(s) △H= ;
则2Mg(s)
+ TiCl4(s)=2MgCl2(s) + Ti(s) △H= ;
 反应2Mg(s) + TiCl4(s)
反应2Mg(s) + TiCl4(s)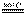 2MgCl2(s)
+ Ti,在Ar气氛中进行的理由是: 。
2MgCl2(s)
+ Ti,在Ar气氛中进行的理由是: 。
 (4)在上述产业链中,合成96
t 甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失)。
(4)在上述产业链中,合成96
t 甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失)。
 (5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电
池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,正极上发生的电极反应为:3O2+6H2O+12e- = 12OH-。该电池中负极上的电极反应式是 。
31.(16分)常温下,在20 mL 0.1 mol/LNa2CO3溶液中逐滴加入40 mL 0.1 mol/L HCl溶液,
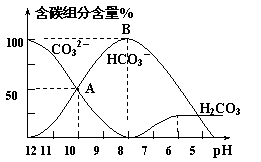 溶液的pH(横坐标)逐渐降低,此时,溶液中含碳元素
溶液的pH(横坐标)逐渐降低,此时,溶液中含碳元素
粒子的物质的量的百分含量(纵坐标)也发生变化
(CO2因逸出未画出),其变化情况如右图所示。
回答下列问题:
(1)Na2CO3溶液呈碱性的原因是(用离子方程
式表示): ;
(2)当反应到A点时,此时溶液中所有阳离子和阴离子的浓度大小关系是:
。
(3)B点表示的含义是 ;
(4)当混合液的pH= 时,开始放出CO2气体。
30.(16分)下图表示某种盐的制备步骤:
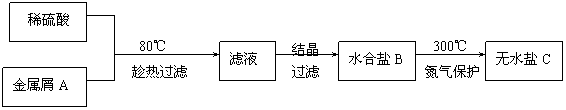
已知:水合盐B含有45.3%的水;无水盐C焙烧分解,放出两种无色刺激性气体E和F(其中E可使品红溶液褪色),并生成红棕色固体D。
(1)请写出物质的化学式:
B , D , F 。
(2)写出C焙烧分解,放出两种无色刺激性气体E和F,并生成红棕色固体D过程的化学方程式 。
(3)本实验的第一步中“趁热过滤”的目的是
。
(4)经查阅资料后发现,该盐在不同温度下结晶可分别得到C·7H2O、C·4H2O和C·H2O。C在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
C·7H2O |
C·4H2O |
C·H2O |
|||||||||
请根据表中数据作出C的晶体的溶解度曲线。
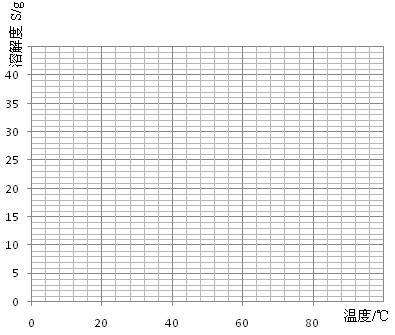
(5)若从C溶液中结晶出C·4H2O晶体,应控制的结晶温度(t)的范围为_______________。
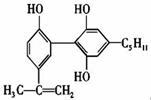 22.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法不正确的是( )
22.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法不正确的是( )
A.该分子中所有碳原子一定处于同一平面中
B.1mol该物质与足量浓溴水反应时,至少消耗4molBr2
C.该物质属于酚类物质,遇到FeCl3:溶液有可能发生显色反应
D.该物质能使酸性KMnO4溶液褪色,即可证明其分子必存在碳碳双键
23.一定温度下,1 molX和n molY在容积为2 L的密闭容器中发生如下反应:
X(g)+Y(g) 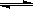 2Z(g)+M(s),
5 min后达到平衡,此时生成a molZ。下列说法正确的是( )
A.向平衡后的体系中加入1
molM,平衡向逆反应方向移动
B.用X表示此反应的反应速率是0.05a
mol•(L•min)-1
C.向上述平衡体系中再充入1
molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
2Z(g)+M(s),
5 min后达到平衡,此时生成a molZ。下列说法正确的是( )
A.向平衡后的体系中加入1
molM,平衡向逆反应方向移动
B.用X表示此反应的反应速率是0.05a
mol•(L•min)-1
C.向上述平衡体系中再充入1
molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
12.下列有关盐溶液的说法中,不正确的是( )
A.在溶质物质的量相等的Na2CO3、NaHCO3 两溶液中,阴离子总数相等
B.常温下,等物质的量浓度的Na2CO3溶液的pH值大于NaHCO3溶液的pH值
C.在NaHCO3溶液中一定有:c(Na+)>c(HCO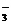 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.在Na2CO3溶液中一定有:c(Na+)十c(H+)=c(HCO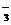 )+c(OH-)十2c(CO
)+c(OH-)十2c(CO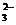 )
)
11.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了
铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁具有某些优点,以下关于这些优点分
析错误的是( )
A.副产工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com