
37.(化学-化学与技术)(15分)
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=___________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比为____________。
(2)步骤二中连续搅拌的目的是:__________________________________________
步骤三中洗涤干净的标准是__________________________________________。
|
 MnFe2O4
MnFe2O4-x+
MnFe2O4
MnFe2O4-x+ 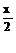 O2↑,MnFe2O4-x+xH2O→MnFe2O4+xH2↑
O2↑,MnFe2O4-x+xH2O→MnFe2O4+xH2↑
请认真回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为:_________
②该化学循环制氢的优点是:_______________________________________________
③该化学循环法制氢尚有不足之处,进一步改进的研究方向是:_________________
________________________________________________________________________
28.(14分)
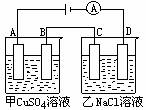 如图,甲烧杯中盛有硫酸铜溶液,乙烧杯中盛有饱和氯化钠溶液。A、B、C、D均为石墨电极。如果电解过程中共有0.2mol电子转移,则:
如图,甲烧杯中盛有硫酸铜溶液,乙烧杯中盛有饱和氯化钠溶液。A、B、C、D均为石墨电极。如果电解过程中共有0.2mol电子转移,则:
(1)甲烧杯中_______极上最多可析出铜______________g。
A极电极反应式________________________________。
(2)乙烧杯中滴入酚酞试液____________极附近先变红。乙烧杯中最后得到___________溶液,此时需加入______________L(标准状况)HCl,才能是溶液恢复原浓度。
27.(15分)
 已知可逆反应:M(g)+N(g) P(g) +Q(g);△H<0 。请回答下列问题:
已知可逆反应:M(g)+N(g) P(g) +Q(g);△H<0 。请回答下列问题:
(1)在此温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2mol/L;达平衡后,M的转化率为50%,求N的转化率_____________;
(2)若升高温度,M的转化率____________(填增大 减小 不变)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=3mol/L,c(N)=a mol/L,达平衡后,c(P)=2mol/L。求a=_____________
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=bmol/L。达平衡后 M的转化率为_______________________。
26.(14)分
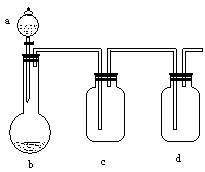
有几个实验小组的同学,利用右图装置进行“一器多用”
的实验探究(a中盛放的液体均匀慢慢滴下;b中盛放的
药品足量;若在c、d中盛放液体,则长导管均浸入液面
以下),每组同学设想在a、b、c、d中分别盛放不同物质,
来制取某种气体并检验其性质。
请你回答以下各组同学在交流实验设计方案中提出的问题:
Ⅰ (1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧
化锰强得多);c:左侧放干燥红布条,右侧放红色鲜花瓣。在实验过程中c中现象能过说明____________________________________________________。
d装置中盛放药品的作用是___________________________________________________,
请写出d中反应的离子方程式_________________________________________________。
(2)若a:稀盐酸;b:贝壳粉;c:饱和碳酸钠溶液;d:饱和苯酚钠溶液。在实验过程中,c中出现的现象是__________________________________________________。
d中现象是_____________________________________________________________,这说明_____________________________________________________________________。
(3)若a:饱和食盐水;b:碳化钙;c:少量酸性高锰酸钾溶液;d:溴水。在实验过程中,c中出现的现象说明生成的气体具有_____________性。d中发生反应的类型是_____________________。多余气体处理方法是____________________________________.
(4)若a:浓氨水;b:生石灰;c:四氯化碳;d:盐酸。在实验过程中,c中出现的现象是___________________________________________________________________。写出d中反应的离子方程式:_________________________________________________
Ⅱ 你认为四组同学在制取气体之前都应该进行的操作是_________________________
__________________________________________________________________________。你还可以利用此装置的a和b两部分还可以制取的气体有(只写一种)_____________。
13.下列叙述中不正确的是( )
A.在0.1mol/L的NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
B.在NaHS中,c(Na+)=2c(S2-)+c(HS-)+c(H2S)
C.CH3COOH和CH3COONa混合液中显酸性,∴c(CH3COO-) >c(Na+)
D.10ml 0.02mol/L的HCl溶液与10ml 0.02mol/L的Ba(OH)2溶液充分混合后,若混合后溶液体积为20ml,则pH=12
 第26-28为必考题,每个试题考生都必须作答。第37-39为选做题,考生根据要求作答
第26-28为必考题,每个试题考生都必须作答。第37-39为选做题,考生根据要求作答
5.0×10-13 mol2·L-2、 8.3×10-17 mol2·L-2 。下列有关说法错误的是( )
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和溶液中加入足量的中浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量的中浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和溶液中加入足量的中浓NaI溶液有AgI沉淀生成
12.常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10mol2·L-2、
10.下列各组离子在指定溶液中可以大量共存的是( )
A.某无色溶液中: Fe2+ H+ ClO- SO42-
B.由水电离出的c(H+)=1×10-12 :NH4+ HCO3- Na+ Cl-
C.加入Al产生氢气的溶液中: Mg2+ NO3- Cl- SO42-
D.使酚酞变红的溶液: SO32- S2O32- Na+ K+
11.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+ OH-(aq) = H2O(l);△H=-57.3kJ/mol
③红磷的化学式为P,白磷的化学式为P4,已知:
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ/mol
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ/mol
下列结论正确的是 ( )
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.稀硫酸和稀氢氧化钠溶液反应的中和热△H=57.3kJ/mol
C.碳的燃烧热大于110.5kJ/mol
D.稀醋酸和稀氢氧化钠溶液反应生成1mol水,放出57.3kJ/mol热量
9.如图所示,夹子开始处于关闭状态,将液体A滴入试管②
与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾
了。则液体A和气体B的组合不可能是下列的 ( )
A.亚硫酸钠溶液、氯气
B.水 、二氧化氮
C.氢氧化钠溶液、一氧化氮
D.氢氧化钠溶液 、氨气
8.用NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.1mol Cl2和足量的铁反应,转移3 mol 电子
B.电解标准状况下的水22.4升,可以得到2mol氢气和1mol 氧气
C.1mol/L的Na2CO3溶液中,c(Na+)=2mol/L
 D.含1molFe3+的FeCl3完全水解,产生Fe(OH)3胶体粒子6.02×1023
D.含1molFe3+的FeCl3完全水解,产生Fe(OH)3胶体粒子6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com