
5.已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: _______________。
(3)写出④中反应的化学方程式: ________________。
第43讲 非金属元素小结
4.有A、B、C、D四种单质。在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙每个分子中都含有10个电子,并且甲、乙、丙、丁有如下关系:

回答:(1)单质B的化学式。
(2)单质A与化合物乙反应的化学方程式。
(3)根据化合物丙、丁中D元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
3.在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得溶液溶质的质量分数为25.26%,则容器中原有H2、O2、Cl2的分子个数比是
A.6:3:1 B.9:6:1 C.13:6:1 D.10:6:1
2.下列氢化物的还原性按由强到弱的顺序排列的是
A.H2Se>H2S>HI>HBr>HCl B.H2S>H2Se>HI>HBr>HCl
C.HI>HBr>HCl>H2S>H2Se D.H2Se>H2S>HCl>HBr>HI
1.关于非金属元素N、O、Cl、P的叙述,正确的是C
A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成
C.都属于主族元素 D.每种元素仅生成一种氢化物
[例1]BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称,若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是____、____。
(2)BGO晶体的化学式是____。
(3)BGO晶体所含铋氧化物的化学式是____。
[例2]由短周期元素形成的四种常见的非金属单质A、B、C、D。在室温下,它们之中有三种气体,一种固体。在这些单质中,B的式量最小,C次之。这些单质和甲、乙、丙、X、Y五种化合物之间存在如下关系:
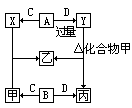
(1)写出化合物乙的化学式______。
(2)上述图示的化学反应共有______种基本反应类型,其中化合反应有______个。
(3)上述四种单质中存在同素异形体的元素是(写元素符号)______。
[例3]某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
 ①猜想:这种试剂可能是:_____________________
①猜想:这种试剂可能是:_____________________
②实验验证: _____________________________
4、常见非全属单质的制取方法
(1)电解法:
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
(2)分解法:如2KClO3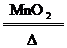 2KCl+3O2↑
2KCl+3O2↑
CH4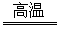 C+2H2 2H2O2
C+2H2 2H2O2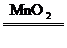 2H2O+O2↑
2H2O+O2↑
(3)置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
(4)氧化法:如MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
(5)还原法:C+H2O CO+H2,Zn+2HCl=ZnCl2+H2↑
CO+H2,Zn+2HCl=ZnCl2+H2↑
2C+ SiO2 Si+2CO↑
Si+2CO↑
3、非金属元素的性质及递变规律
(1)单质的熔沸点与聚集态:
①小分子物质。如H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As等,通常为液态或固态,均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体.
(2)单质导电性:
非金属一般属于非导体,金属是电的良导体,而锗、硅、砷、硒等属于半导体,石墨、碲属于电的良导体。
(3)单质的化学活性及反应

③非金属一般为成酸元素,难以与稀酸反应,固体非金属能被氧化性酸氧化。
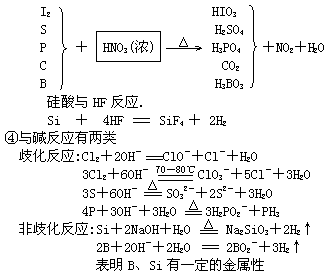
 (4)氢化物
(4)氢化物
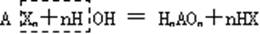
(5)卤化物:易水解
如 PCl3+3H2O=H3PO3+3HCl , SiCl4+3H2O=H2SiO3+4HCl
BCl3+3H2O=H3BO3+3HCl BrF5+3H2O=HBrO3+5HF
利用此法可制得氢卤酸和含氧酸
(6)含氧酸
① 同周期非金属元素最高价含氧酸从左到右酸性增强
② 氧化性:同种元素低价强于高价含氧酸
如: HClO>HClO3>HClO4(稀) H2SO3>H2SO4(稀) HNO2>HNO3(稀)
③氧化性酸与还原性酸
常见的强氧化性酸有:HNO3、浓H2SO4、HClO等。
常见的还原性酸有:H2SO3、H3PO3等。
HNO2既有氧化性,又有还原性,但以氧化性为主。
④某些酸的特殊性质
浓H2SO4:吸水性→做干燥剂;脱水性→使晶体脱结晶水,使有机物碳化。
HClO:漂白作用。漂白原理与Na2O2同,是利用强氧化性破坏有色物质。
H2SO3:漂白作用。与某些有色物质结合生成不稳定的无色物质,加热后恢复原色。
HF:与SiO2反应。SiO2+4HF→SiF4↑+2H2O
注意:酸的氧化性与氧化性酸是两个不同的概念。酸的氧化性就是指酸中H+结合电子的性质,凡酸皆有此性质。而氧化性酸是指含氧酸的中心元素结合电子的性质。
2、非金属元素在周期表中的位置及结构特点
(1) 除H外,非金属元素均在“金属与非金属分界线”的右上方。
(2) 非金属元素(包括稀有元素)均在主族(零族)。
(3) 最外层电子数一般≥4(H、B除外)
(4) 原子半径比同周期金属半径小(稀有元素除外)。
5.酸式盐的种类、性质、形成及其电离与水解。
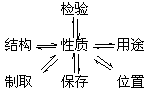 复习方法:(1)每族元素抓住代表物,重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识,并理清下列关系:
复习方法:(1)每族元素抓住代表物,重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识,并理清下列关系:
(2)运用元素周期表知识比较每族元素与其代表物在结构、性质上的相似性、递变性和特殊性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com