
27.(14分)人类根据肤色不同分成黄种人、黑种人、白种人等。人类肤色的深浅与皮肤血管内红细胞中的血色素颜色,以及皮肤细胞内黑色素的含量等有关。皮肤中黑色素的多少由两对独立遗传的基因(E、e和F、f)所控制,基因E和F可以使黑色素量增加,两者增加的量相等,并可以累加。请回答以下问题:
(1)不同区域不同肤色的人通婚,能生出健康的混血儿,说明不同肤色的人之间不存在___________。
(2)基因E和基因F的区别,从分子水平上看,取决于基因中 不同。基因E或基因F也可以通过转基因技术,在酵母菌、西红柿等生物体内成功表达,这说明不同的生物共用_____________。
(3)如果夫妇基因型均为EeFf,从理论上推算,所生子女皮肤的颜色深浅有_________种类型,其比例为________。
(4)人类的白化病是由于控制酪氨酸酶的基因异常引起的。若自然人群中白化病基因(a)携带者的频率约为1%,红绿色盲基因(b)携带者的频率约为7%。那么,一对表现型正常的夫妇生出一个白化病色盲患儿的概率是_____________(列式表示即可),该患儿的基因型为___________
[选考部分](共35分)
第Ⅱ卷选考部分共5题,共35分。其中第28、29题为物理题,第30、31题为化学题。考生从两道物理、两道化学题中各任选一题作答,若28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上
26.(26分)Ⅰ.右图为光照强度一定时,大豆植株在
不同02浓度下,CO2吸收速率的变化曲线。请回答下
列问题:(1)由图可知,随着O2浓度的升高,大豆植株
对CO2的吸收速率逐渐 ,这种影响在外界
CO2浓度较 时,对大豆的生存威胁更大。
(2)实验表明:在强光下,O2参与叶绿素与类胡萝卜
素的光氧化,从而影响光合作用光反应阶段,使其产
生的 减少,暗反应随之受到影响。
(3)综上所述,要提高大豆的产量,所需的最适外界
条件是较高温度、适宜光照、较高 和较低 等。
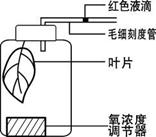 (4)为了验证上述氧浓度对绿色植物光合作用的影响,某同学设置了如下实验装置。请回答下列问题:
(4)为了验证上述氧浓度对绿色植物光合作用的影响,某同学设置了如下实验装置。请回答下列问题:
①该实验的自变量是_______。在实验过程中,每组实验的叶片状况、实验时间、 等要一致,以排除无关变量对该实验的影响。
②预测实验结果:随着氧浓度的升高,红色液滴将向_______(“左”或“右”)移动,并且移动速度逐渐_________。
Ⅱ.人在饥饿时,遇到寒冷刺激,会表现出面色苍白,全身颤抖。这是由于体内血糖浓度下降,细胞产热不足以维持正常体温而引起的。机体可以通过神经系统中的大脑皮层、_________和垂体,以及内分泌腺中的肾上腺、胰岛和 等的调节作用,一方面通过 方式加速热量的产生,引起全身颤抖;另一方面通过
方式,减少热量散失,导致面色苍白。
25.(17分)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
溶液开始变蓝时间(min) |
||||
|
0.1 mol·L-1 KI溶液 |
H2O |
0.01 mol·L-1 X 溶液 |
0.1 mol·L-1 双氧水 |
1 mol·L-1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
0 |
10.0 |
10.0 |
40.0 |
无 |
t |
|
5 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m= ,n=
(2)已知,I2与X反应时,两者物质的量之比为1:2。实验3从开始至反应进行到2.8min时,此段时间内H2O2+2H++2I-→2H2O+I2反应速率v(I-)=_________________。
(3)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=___________。
②根据上表数据可知,a、b的值依次为 和 。
(4)实验5表明:硫酸铁能提高反应速率。
①催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程。
、 (不必配平)
 (5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是
。
(5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是
。
24.(13分)鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。

(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是 。
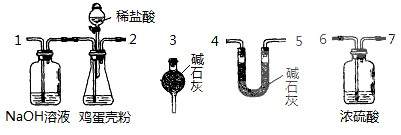
(4)有同学提出可采用如右装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。
①采用该方法进行实验,各装置从左到右的连接顺序依次1-2-__________________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:________(填“准确”、“不准确”或“无法判断”)。原因是_____________________。
23.(15分)TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
 其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。答: 。
II、TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s) +2Cl2
(g)  TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s) + O2 (g) = CO2 (g) △H = - 394 kJ·mol-1。请填空:
TiO2 (s) + C (s) +2Cl2 (g) = TiCl4 (l) + CO2 (g) △H = ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________________________。
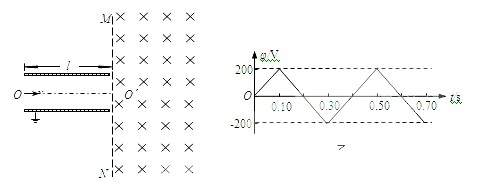
22.(20分)如图甲所示,两平行金属板的板长l=0.20m,板间距d= 0.12m,在金属板右侧有一范围足够大的方向垂直于纸面向里的匀强磁场,其边界为MN,与金属板垂直。金属板的下极板接地,上极板的电势φ随时间变化的图线如图乙所示,匀强磁场的磁感应强度B=1.0×10-2T。现有带正电的粒子以V0=5.0×105m/s的速度沿两板间的中线OO'连续进入电场,经
电场后射入磁场。已知带电粒子的比荷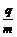 =
= ×108C/kg,粒子的重力忽略不计,假设在粒
×108C/kg,粒子的重力忽略不计,假设在粒
子通过电场区域的极短时间内极板间的电压可以看作不变,不计粒子间的作用。
(1)求t=0时刻进入的粒子,经边界MN射入磁场和射出磁场时两点间的距离;
(2)求t=0.30s时刻进入的粒子,在磁场中运动的时间;
(3)求t1=0.05s时刻和t2=0.10s时刻,射入电场的粒子,经边界MN射入磁场和射出磁场时两点间的距离之比。
21.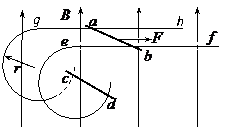 (19分)如图所示,足够长的光滑平行金属导轨ef和gh水平放置且相距L,在其左端各固定一个半径为r的四分之三金属光滑圆环,两圆环面平行且竖直。在水平导轨和圆环上各放有一根质量为m,电阻为R与导轨垂直的金属杆ab、cd,其余电阻不计。整个装置处于磁感应强度大小为B、方向竖直向上的匀强磁场中。当用水平向右的恒力
(19分)如图所示,足够长的光滑平行金属导轨ef和gh水平放置且相距L,在其左端各固定一个半径为r的四分之三金属光滑圆环,两圆环面平行且竖直。在水平导轨和圆环上各放有一根质量为m,电阻为R与导轨垂直的金属杆ab、cd,其余电阻不计。整个装置处于磁感应强度大小为B、方向竖直向上的匀强磁场中。当用水平向右的恒力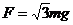 拉细杆ab,并最终达到匀速运动时,杆cd恰好静止在圆环上某处,试求:
拉细杆ab,并最终达到匀速运动时,杆cd恰好静止在圆环上某处,试求:
(1)杆ab做匀速运动时,回路中的感应电流的大小和方向;
(2)杆ab做匀速运动时的速度;
(3)杆cd静止的位置距圆环最低点的高度。
20.(15分)一个质量为m的蓝球从距地板H高处由静止释放,测得其下落时间为t,从地板反弹的高度为h(H>h), 如果运动过程空气阻力大小不变,请求出:
(1)从开始下落到反弹到h高处过程中损失的机械能;
(2)蓝球所受空气阻力的大小.
19. (1)小明和小红同学对如图所示的自制“橡皮筋测力计”进行标度(均在橡皮筋的弹性范围内进行)。
(1)小明和小红同学对如图所示的自制“橡皮筋测力计”进行标度(均在橡皮筋的弹性范围内进行)。
①小明测量了不挂钩码和挂1个钩码时的指针指在刻度尺上的位置分别为5.00cm和5.60cm,然后根据所学弹簧弹力的知识,经过类比,按弹簧测力计的刻度规律在刻度尺上依次进行了标度,则
小明应在刻度尺 cm处标示挂5个钩码的指针位置。
②小红分别测量了不挂钩码、挂1个钩码、挂2个钩码……指针在刻度尺上的位置,并按实际测量进行标度,其数据如下表:
|
挂钩码的个数 |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
指针在刻度尺上的位置x(cm) |
5.00 |
5.60 |
6.30 |
7.20 |
8.30 |
9.60 |
11.00 |
12.50 |
请在右图坐标上画出指针在刻度尺上的所指的刻度x与所挂钩码个数的关系图像。
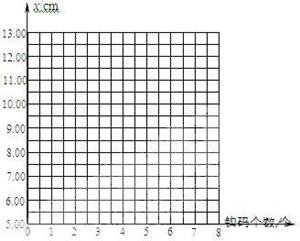
③请你分析小明和小红的标度方法谁更科学(说明理由) 。
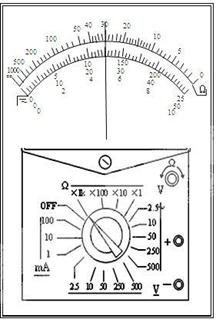
(2)某同学进行测量电阻R的阻值的实验。他先用多用电表进行粗测,电表示数如图。然后用伏安法进行较精确的测量,现已选定滑动变阻器(阻值0~200Ω),开关一只,导线若干,另有如下备选器材:
A.电源(E=16V,r=2Ω)
B.电源(E=3V,r=0.5Ω)
C.电压表(量程0~15V,内阻约50kΩ)
D.电压表(量程0~3V,内阻约10kΩ)
E.电流表(量程0~500μA,内阻约500Ω)
F.电流表(量程0~1mA,内阻约250Ω)
请回答如下问题:
①多用电表的读数 ;
 ②用伏安法测量还应选用的器材为
;
②用伏安法测量还应选用的器材为
;
(请填写器材前的符号)
③请在右边的方框图中画出实验电路原理图。
18.如图所示,M是一小型理想变压器,接线柱a、b 接在电压u=311sin314t(V)的正弦交流电源上,变压器右侧部分为一火警报警系统电路图,其中R2为用半导体热敏材料制成的
传感器(该热敏材料的电阻率随温度升高而
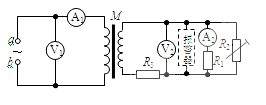 减小),电流表A2为值班室的显示器,显示
减小),电流表A2为值班室的显示器,显示
通过R1的电流,电压表V2显示加在报警器
上的电压,R3为一定值电阻。当传感器R2
所在处出现火警时,以下说法中正确的是
A.变压器输出端的交变电流的频率为314Hz
B.V1的示数是311V
C.A1的示数不变,A2的示数减小
D.V1的示数不变,V2的示数减小
第Ⅱ卷
本卷共192分,包括必考题和选考题两部分。第19~27和32题为必考题;第28~31为选考题,考生根据要求选择作答。
[必考部分](共157分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com