
49.以下各组句子中,全部说明嵇绍敢于直言谏劝的一组是 ( )
①时人许以致远,绍以为必不成器
②以不阿比凶族,封弋阳子
③自顷礼官协情,谥不依本
④宜省起造之烦,深思谦损之理
⑤当轨物作则,垂之于后
⑥若释公服从私宴,的不敢辞也。
A.①②⑤ B.①③⑥
C.②④⑥ D.③④⑤
48.对下列句子中加点的词的解释,不正确的一项
是 ( )
A.山涛领选,启武帝 启:禀告。
B.如卿所言,乃堪为丞 堪:能够。
C.尚书左仆射裴颁亦深器之 器:看重。
D.时人许以远致 许:答应。
19.某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案。[方案一]气体分析法。
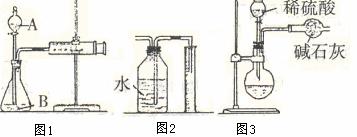
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的C02气体的体积。实验开始时检查该装置气密性的方法是
。
(2)乙同学用图2代替图1中的收集装置,则所测CO2气体的体积 (填“偏大”、“偏小”、“不变”),你的改进方案是 。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I ;
Ⅱ ;
Ⅲ 。
[方案二]沉淀分析法(如图所示)。
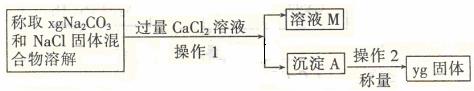
(4)操作1的名称是 ;操作2的名称是 。在进行操作1之前,应判断是否沉淀完全,判断的方法是
。
(5)根据沉淀分析法,该固体混合物中Na2CO3质量分数的计算式为 。
18.工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
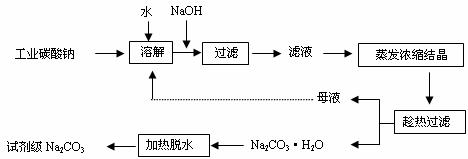
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
Ⅱ、有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
 (1)加入NaOH溶液时发生的离子方程式为
。
(1)加入NaOH溶液时发生的离子方程式为
。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
17.过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:
2Na2CO3 + 3H2O2 = 2 Na2CO3·3H2O2 △H<0
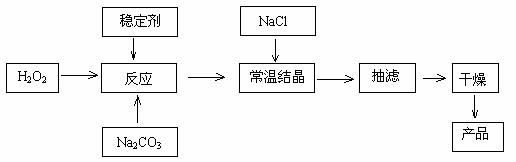
回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是 。
(2)下列物质可使过碳酸钠较快失效的是 。
A.MnO2 B.H2S C.稀硫酸 D.NaHCO3
(3)加入NaCl的作用是 。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是 。
(5)反应的最佳温度控制在15℃-20℃,温度偏高时造成产率低的可能原因有 ,温度偏低时造成产率低的可能原因有 。
16、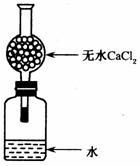 某校学生课外活动小组为测定Na元素的相对原
某校学生课外活动小组为测定Na元素的相对原
子质量,设计的装置如右图,从实验室取出bg(不足量)的
钠放入水中,塞紧瓶塞,使钠完全反应,试回答:
(1)实验室取用一小块钠,需要的用品有_________________。
(2)此干燥管的作用是________________,若不用此干燥管,
则测出相对原子质量会比实际相对原子质量________
(填“偏大”、“偏小”或“不变”,下同),若此钠块有极少量被氧
化,则结果会_____________。
(3)有甲同学建议在图中干燥管上再第二个干燥管(设此干燥管质量为mg,包括干燥剂的质量),其目的是__________________,称得反应前装置(包括水和干燥剂)的总质量为ag。完全反应后再称量此装置的总质量为cg,且第二个干燥管质量变为m1g,则依甲同学建议,计算钠的相对原子质量的表达式为_______________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在广口瓶中再加入一定量煤油,其目的是______________________________________。
15.某兴趣小组为探究Na2O2滴入酚酞试液中时溶液颜色变化的原因,设计如下方案。将2角匙Na2O2加入滴有3~4滴酚酞试剂的蒸馏水(10ml)中,发现有如下现象:
立即有大量气泡生成。
无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,重新变为无色。
反应放出大量的热量,试管壁手触感觉很烫。 请回答:
(1)写出Na2O2的电子式 ,
如何检验生成的气体是氧气? 。
(2)该兴趣小组同学认为酚酞试液颜色变化的原因可能是:
① 。
②Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色。
③可能是反应放出的热量,使红色消失。
(3)假如是原因②请帮助该兴趣小组同学设计补充试验进一步说明酚酞试液褪色的原因
。
(4)为验证原因③,可以设计补充实验验证。请写出操作过程
。
14.Na2O2与水的反应实际是Na2O2 +
2H2O === 2NaOH + H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2===2H2O
+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20 mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500ml、250ml、150ml的量筒备用,应选用量程为 的量筒,理由是
 ;
;
 (2)有酸式和碱式两种滴定管备用,该实验应选用
, 理由是
;
(2)有酸式和碱式两种滴定管备用,该实验应选用
, 理由是
;
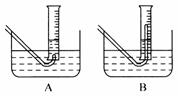
 (3)在步骤③测量气体体积时,必须待试管和量筒内的气
体都冷却到室温时进行,应选用下图装置中
,理由是
;此时量筒内的液面高于水槽中液面,立即读数会使Na2O2的纯度 (填“偏高”“偏低”或“不变”);应进行的操作是 ;
(3)在步骤③测量气体体积时,必须待试管和量筒内的气
体都冷却到室温时进行,应选用下图装置中
,理由是
;此时量筒内的液面高于水槽中液面,立即读数会使Na2O2的纯度 (填“偏高”“偏低”或“不变”);应进行的操作是 ;
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是 ;
(5)该过氧化钠的纯度为 (实验中得到的气体体积均看作为标准状况下)。
13.金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
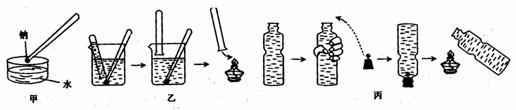
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金
钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失 B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色 D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→_______________________________________→用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是( )
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,共排出水的体积为16.8mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用的钠的质量为________g。
12.在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是
A.9:5 B.1:1 C.7:6 D.6:7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com