
2.若 ,其中a、b∈R,
,其中a、b∈R,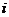 是虚数单位,则
是虚数单位,则 =( )
=( )
A.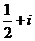 B.
B.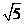 C.
C.
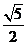 D.
D.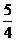
1.若集合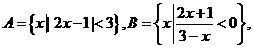 则A∩B是(
)
则A∩B是(
)
A. B.
B.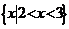
C. D.
D.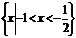
22. (8分)钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
(8分)钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
 2FeTiO3+7Cl2+6C
2TiCl4+2FeCl3+6CO
2FeTiO3+7Cl2+6C
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C TiCl4+2CO
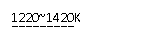 将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
TiCl4+2Mg Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为 。
(2)与CO互为等电子体的离子为 (填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp1杂化的分子有 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于
(填“原子”、“分子”或“离子”)晶体。
 (5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其
中金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
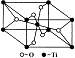
20.(10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究性学习小组为了测定空气
中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
。
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)
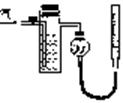
方案二:如右图所示,装置中反应管内装有碘的淀粉溶液。
按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此
装置时,其中的SO2被吸收,量气管内增加的体积为其余气
体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”、“偏低”或“不受影响”)。
(5)反应管内碘的淀粉溶液可以用下列 (填代号)代替。
A.NaOH溶液 B.酸性KMnO4溶液
C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是 。
以下为选作题,考生只需从中任选一题作答,若两题均做,则以前一个题目得分为准。
 21.(8分)已知:
21.(8分)已知:
(1)该反应的生成物中含有的官能团的名称为 ,该类物质在一定条件下能发生 (填序号)。
①银镜反应 ②酯化反应 ③还原反应 ④消去反应 ⑤加成反应
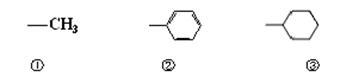
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子都在同一平面内,R1可以为 (填序号);
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:

结构分析表明E分子中含两个甲基且没有支链。试回答:
①写出C的分子式 ;写出A的结构简式 。
②写出由D生成E的的化学方程式 。
19.(12分)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:
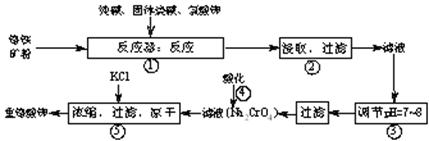
 涉及的主要反应为:
涉及的主要反应为:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O

 在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式 。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)
。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为: Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1 mL待测液应选用的仪器为 (写仪器名称)。
②判断达到滴定终点的依据是 。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为
(不必化简)。
18. (10分)某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)
2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
(10分)某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)
2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)= 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)
a.0.82mol•L-1 b.0.25mol•L-1 c.0.20mol•L-1 d.0.08mol•L)
 (4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡 移动(填“向右”、“向左”或“不”),化学平衡常数
(填“增大”、“减少”或“不变”)。
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡 移动(填“向右”、“向左”或“不”),化学平衡常数
(填“增大”、“减少”或“不变”)。
(5) 其它条件不变,在第5min末将容器的体积缩小
一半,若第8min达到新的平衡(此时NH3的物
质的量约为0.25mol),请在上图中画出第5min
末到此平衡时NH3物质的量浓度的变化曲线。
15.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
B.0.1mol·L-1的NaHCO3溶液中c(Na+)= c(HCO3-)+ c(H2CO3)+ 2c(CO32-)
C.0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
14.用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4(g)+4NO2(g)=4NO(g)+ CO2(g) + 2H2O(g) △H=-574kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol一1
下列说法不正确的是 ( )
A.若用标准状况下 4.48LCH4 还原 NO2生成N2和水蒸气,放出的热量为 173.4kJ
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H >-574 kJ·mol-1
C.反应 ①② 转移的电子数相同
D.反应 ②中当4.48LCH4 反应完全时转移的电子总数为1.60 mol
13.肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。电池总反应为:N2H4+O2=N2+2H2O。下列关于该燃料电池工作时的说法正确的是 ( )
A.负极的电极反应式是:N2H4+4OH-→4H2O+N2↑+4e-
B.正极的电极反应式是:O2+4H++4e-→2H2O
C.溶液中阴离子向正极移动
D.电解后电解质溶液的碱性增强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com