
10、(15分)草酸三氢钾是一种重要的化学试剂,广泛用于分析试剂及缓冲溶液的配制,等级为分析纯(A.R)的产品售价大约每公斤70元.下面是草酸三氢钾的产品标签。
化学名称:草酸三氢钾、四草酸钾、乙二酸三氢钾、四乙二酸钾
英文名:potassium trihydrogen dioxalate dihydrate或potassium tetraoxalate
分子式:KHC2O4•••••••H2C2O4•2H2O或C4H3KO8•2H2O
分子量:254.19
性质:无色晶体或白色粉末。热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇
质量指标:KHC2O4•••••••H2C2O4•2H2O含量,分析纯(A.R)大于99.5%,化学纯(C.P)大于99.0%
对产品的质量鉴定可以采用氧化还原滴定法,操作步骤如下 :称取草酸三氢钾样品1.271g,溶解后定容在100mL容量瓶A中,用移液管移取25.00mL到锥形瓶中,加硫酸酸化后,用0.04000mol•L_1KMnO4溶液滴定至终点,消耗24.91mL。
(1)写出发生的滴定的离子反应方程式 。(3分)
(提示:滴定反应可视为草酸与高锰酸钾反应)
(2)该滴定使用什么指示剂,终点的颜色将怎样变化?
(4分)
(3)通过计算可知该草酸三氢钾样品的质量分数为 (3分)
(4)该产品属于哪种等级的化学试剂 (2分)
(5)采用氧化还原滴定法操作时可以观察到这样的现象,刚刚加入第一滴KMnO4到草酸三氢钾溶液中,溶液呈现紫红色,大约3分钟紫红色褪去,随后加入的KMnO4紫红色则 立即褪去。请对这一现象给出解释。
立即褪去。请对这一现象给出解释。
(3分)
9、(15分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
 ①该反应的平衡常数表达式为:K=
。(2分)
①该反应的平衡常数表达式为:K=
。(2分)
 ②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单
 质铁11.2g。则10min内CO的平均反应速率为
。(2分)
质铁11.2g。则10min内CO的平均反应速率为
。(2分)
 (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
 ①
②
。(6分)
①
②
。(6分)
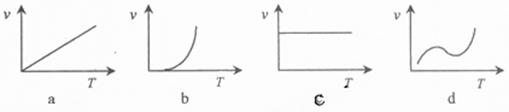
 (3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是 ▲ 。(2分)
和温度(T)的关系示意图中与铝热反应最接近的是 ▲ 。(2分)

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
,
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:
,
 欲使上述体系中Al3+浓度增加,可加入的物质是
。(3分)
欲使上述体系中Al3+浓度增加,可加入的物质是
。(3分)
8、(14分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验① 。
实验② 。
实验③ 。
实验④ 。
实验⑤ 。
(2)上述5个实验不能确定是否的离子是 。
7、下图为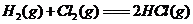 反应的能量变化示意图:
反应的能量变化示意图:
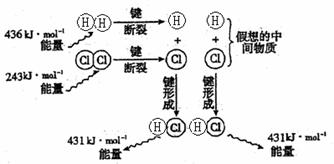
.
据图判断,下列叙述中正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是:
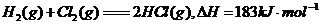
B.氢气的燃烧热是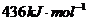
C.强光照射能加快氢气和氯气化合的反应速率
D.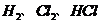 中各原子最外层都达到了
中各原子最外层都达到了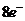 结构
结构
6、0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是 ( )
A.[Na+]+[K+]+[H+]=[SO42-]+[S2-]+[HS-]+[OH-]
B.[Na+] > [K+] > [H+] > [OH-]
C.[Na+]=2[S2-]+[H2S]+[HS-]+2[SO42-]
D.[SO42-] > [HS-] > [OH-] > [H+]
5、根据表1信息,判断以下叙述正确的是 ( )
表1部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
4、下列实验操作或事故处理中,正确的做法是 ( )
A银镜反应实验后附有银的试管,可用稀H2SO4清洗
B在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C不慎将NaOH溶液沾在皮肤上,立即用稀醋酸溶液冲洗
D在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
3、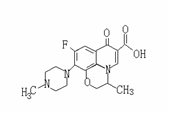 氧氟沙星是常用抗菌药,其结构简式如题图所示,下列叙述错误的是 ( )A. 氧氟沙星能发生加成、取代反应
氧氟沙星是常用抗菌药,其结构简式如题图所示,下列叙述错误的是 ( )A. 氧氟沙星能发生加成、取代反应
B. 氧氟沙星用氢氧化钠的水溶液加热处理后,加入FeCl3溶液可以 观察到溶液显紫色。
C. 氧氟沙星能和盐酸反应
D. 氧氟沙星能发生还原、酯化反应
2、下列反应的离子方程式书写正确的是 ( )
A.用氢氟酸腐蚀玻璃:4H++4F-+SiO2==SiF4+2H2O
B.硫酸铜溶液中加过量氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
C.硫酸铜溶液中通入硫化氢 Cu2++H2S=CuS↓+2H+
D.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+
+ 2OH- CH3COONH4+3NH3 + 2Ag↓+ H2O
CH3COONH4+3NH3 + 2Ag↓+ H2O
1、下列涉及有机物的性质或应用的说法不正确的是 ( )
A.干馏煤可以得到甲烷、苯和氨等重要化工原料
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.用大米酿的酒在一定条件下密封保存,时间越长越香醇
D. 玛瑙和餐桌上的瓷盘都是硅酸盐制品
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com